Автор:
Sara Rhodes
Жаратылган Күнү:
12 Февраль 2021
Жаңыртуу Күнү:
1 Июль 2024
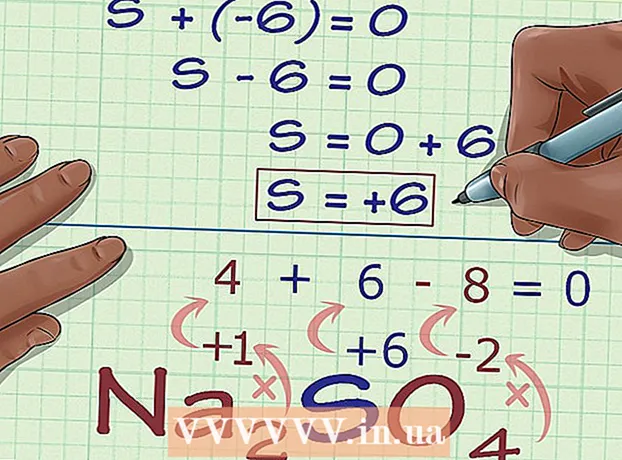
Мазмун
- Кадамдар
- 2 ичинен 1 -бөлүк: Химиянын мыйзамдарына ылайык кычкылдануу абалын аныктоо
- 2дин 2 -бөлүгү: Химиянын мыйзамдарын колдонбостон кычкылдануу абалын аныктоо
- Кеңештер
- Сага эмне керек
Химияда "кычкылдануу" жана "калыбына келтирүү" термини бир атомдун же атомдордун тобунун электронун жоготкон же алган реакцияларын билдирет. Кычкылдануу абалы - бул бир же бир нече атомго берилген сандык мааниси, ал кайра бөлүштүрүлгөн электрондордун санын мүнөздөйт жана реакция учурунда бул электрондор атомдор арасында кантип бөлүштүрүлгөнүн көрсөтөт. Бул маанини аныктоо атомдорго жана алардан турган молекулаларга жараша жөнөкөй жана өтө татаал процедуралар болушу мүмкүн. Мындан тышкары, кээ бир элементтердин атомдору бир нече кычкылдануу абалына ээ болушу мүмкүн. Бактыга жараша, кычкылдануу абалын аныктоонун жөнөкөй бирдиктүү эрежелери бар, аларды ишенимдүү колдонуу үчүн химиянын жана алгебранын негиздерин билүү жетиштүү.
Кадамдар
2 ичинен 1 -бөлүк: Химиянын мыйзамдарына ылайык кычкылдануу абалын аныктоо
 1 Каралып жаткан зат элементардык экенин аныктаңыз. Химиялык кошулманын сыртындагы атомдордун кычкылдануу абалы нөлгө барабар. Бул эреже өзүнчө эркин атомдордон пайда болгон заттар үчүн да, бир элементтин эки же полиатомдук молекуласынан турган заттар үчүн да туура.
1 Каралып жаткан зат элементардык экенин аныктаңыз. Химиялык кошулманын сыртындагы атомдордун кычкылдануу абалы нөлгө барабар. Бул эреже өзүнчө эркин атомдордон пайда болгон заттар үчүн да, бир элементтин эки же полиатомдук молекуласынан турган заттар үчүн да туура. - Мисалы, Ал(лар) жана Cl2 0 кычкылдануу абалына ээ, анткени экөө тең химиялык байланышсыз элемент абалында.
- Белгилей кетсек, күкүрттүн аллотроптук түрү С.8, же октацера, анын типсиз түзүлүшүнө карабастан, нөлдүк кычкылдануу абалы менен да мүнөздөлөт.
 2 Каралып жаткан заттын иондордон тургандыгын аныктаңыз. Иондордун кычкылдануу абалы алардын зарядына барабар. Бул эркин иондорго да, химиялык кошулмалардын курамына киргендерге да тиешелүү.
2 Каралып жаткан заттын иондордон тургандыгын аныктаңыз. Иондордун кычкылдануу абалы алардын зарядына барабар. Бул эркин иондорго да, химиялык кошулмалардын курамына киргендерге да тиешелүү. - Мисалы, Cl ионунун кычкылдануу абалы -1.
- NaCl химиялык кошулмасындагы Cl ионунун кычкылдануу абалы да -1. Na ионунун аныктамасы боюнча +1 заряды бар болгондуктан, Cl ионунун заряды -1, демек анын кычкылдануу даражасы -1 деген жыйынтыкка келебиз.
 3 Сураныч, металл иондору бир нече кычкылдануу абалына ээ болушу мүмкүн экенин эске алыңыз. Көптөгөн металл элементтеринин атомдору ар кандай өлчөмдө иондошот. Мисалы, темир (Fe) сыяктуу металлдын ион заряды +2 же +3. Металл иондорунун заряды (жана алардын кычкылдануу даражасы) бул металл химиялык кошулманын бир бөлүгү болгон башка элементтердин иондорунун заряддары менен аныкталышы мүмкүн; текстте бул заряд рим цифралары менен белгиленет: мисалы, темир (III) +3 кычкылдануу абалына ээ.
3 Сураныч, металл иондору бир нече кычкылдануу абалына ээ болушу мүмкүн экенин эске алыңыз. Көптөгөн металл элементтеринин атомдору ар кандай өлчөмдө иондошот. Мисалы, темир (Fe) сыяктуу металлдын ион заряды +2 же +3. Металл иондорунун заряды (жана алардын кычкылдануу даражасы) бул металл химиялык кошулманын бир бөлүгү болгон башка элементтердин иондорунун заряддары менен аныкталышы мүмкүн; текстте бул заряд рим цифралары менен белгиленет: мисалы, темир (III) +3 кычкылдануу абалына ээ. - Мисал катары алюминий ионун камтыган кошулманы карап көрөлү. AlCl кошулмасынын жалпы заряды3 нөлгө барабар.Cl иондорунун заряды -1, жана кошулмада 3 ушундай ион бар экенин билгендиктен, каралып жаткан заттын жалпы бейтараптуулугу үчүн, Ал иондун заряды +3 болушу керек. Ошентип, бул учурда алюминийдин кычкылдануу абалы +3.
 4 Кычкылтектин кычкылдануу абалы -2 (кээ бир өзгөчөлүктөрдү эске албаганда). Дээрлик бардык учурларда кычкылтек атомдору -2 кычкылдануу абалына ээ. Бул эрежеден бир нече өзгөчөлүктөр бар:
4 Кычкылтектин кычкылдануу абалы -2 (кээ бир өзгөчөлүктөрдү эске албаганда). Дээрлик бардык учурларда кычкылтек атомдору -2 кычкылдануу абалына ээ. Бул эрежеден бир нече өзгөчөлүктөр бар: - Эгерде кычкылтек элементардык абалда болсо (О2), анын кычкылдануу абалы 0, башка элементардык заттар сыяктуу.
- Эгерде кычкылтек бир бөлүгү болсо пероксид, анын кычкылдануу абалы -1. Пероксиддер-жөнөкөй кычкылтек-кычкылтек байланышын камтыган бирикмелер тобу (б.а. пероксиди анион О2). Мисалы, Х2О2 (суутек перекиси) кычкылтектин заряды жана кычкылдануу абалы -1.
- Фтор менен айкалышканда кычкылтек +2 кычкылдануу абалына ээ, төмөндөгү фтордун эрежесин окуңуз.
 5 Водород бир аз өзгөчөлүктөрдү эске албаганда, +1 кычкылдануу абалына ээ. Кычкылтек сыяктуу эле, өзгөчөлүктөр да бар. Эреже катары, суутектин кычкылдануу абалы +1 (эгерде ал H элементтик абалда болбосо)2). Бирок, гидриддер деп аталган кошулмаларда суутектин кычкылдануу абалы -1.
5 Водород бир аз өзгөчөлүктөрдү эске албаганда, +1 кычкылдануу абалына ээ. Кычкылтек сыяктуу эле, өзгөчөлүктөр да бар. Эреже катары, суутектин кычкылдануу абалы +1 (эгерде ал H элементтик абалда болбосо)2). Бирок, гидриддер деп аталган кошулмаларда суутектин кычкылдануу абалы -1. - Мисалы, Х2O Суутектин кычкылдануу абалы +1, анткени кычкылтек атомунун заряды -2, ал эми жалпы нейтралитет үчүн эки +1 заряд талап кылынат. Ошентсе да, натрий гидридинин курамында суутектин кычкылдануу абалы -1, анткени Na иону +1 зарядын көтөрөт, ал эми жалпы электрондор үчүн суутек атомунун заряды (жана ошону менен анын кычкылдануу абалы) бол -1.
 6 Фтор дайыма кычкылдануу абалына ээ -1. Жогоруда айтылгандай, кээ бир элементтердин кычкылдануу абалы (металл иондору, кычкылтектин кычкылтек атомдору ж. Фтордун кычкылдануу абалы дайыма -1. Мунун себеби, бул элементтин эң чоң электр терс жөндөмдүүлүгүнө ээ - башкача айтканда, фтор атомдору өз электрондору менен ажырашууга эң аз даяр жана чет элдик электрондорду активдүү тартууда. Ошентип, алардын акысы өзгөрүүсүз бойдон калууда.
6 Фтор дайыма кычкылдануу абалына ээ -1. Жогоруда айтылгандай, кээ бир элементтердин кычкылдануу абалы (металл иондору, кычкылтектин кычкылтек атомдору ж. Фтордун кычкылдануу абалы дайыма -1. Мунун себеби, бул элементтин эң чоң электр терс жөндөмдүүлүгүнө ээ - башкача айтканда, фтор атомдору өз электрондору менен ажырашууга эң аз даяр жана чет элдик электрондорду активдүү тартууда. Ошентип, алардын акысы өзгөрүүсүз бойдон калууда.  7 Бирикмедеги кычкылдануу абалынын суммасы анын зарядына барабар. Химиялык кошулманы түзгөн бардык атомдордун кычкылдануу абалдары бул кошулманын зарядын кошушу керек. Мисалы, эгерде кошулма нейтралдуу болсо, анын бардык атомдорунун кычкылдануу абалынын суммасы нөлгө барабар болушу керек; эгер кошулма -1 заряды бар полиатомдук ион болсо, кычкылдануу абалынын суммасы -1, ж.б.
7 Бирикмедеги кычкылдануу абалынын суммасы анын зарядына барабар. Химиялык кошулманы түзгөн бардык атомдордун кычкылдануу абалдары бул кошулманын зарядын кошушу керек. Мисалы, эгерде кошулма нейтралдуу болсо, анын бардык атомдорунун кычкылдануу абалынын суммасы нөлгө барабар болушу керек; эгер кошулма -1 заряды бар полиатомдук ион болсо, кычкылдануу абалынын суммасы -1, ж.б. - Бул жакшы сыноо ыкмасы - эгерде кычкылдануу абалынын суммасы кошулманын жалпы зарядына барабар болбосо, анда сиз бир жерде жаңылгансыз.
2дин 2 -бөлүгү: Химиянын мыйзамдарын колдонбостон кычкылдануу абалын аныктоо
 1 Кычкылдануу абалы жөнүндө катуу эрежелери жок атомдорду табыңыз. Кээ бир элементтер үчүн кычкылдануу абалын табуу боюнча эч кандай бекем эрежелер жок. Эгерде атом жогоруда саналып өткөн эрежелердин бирине да туура келбесе жана анын зарядын билбесеңиз (мисалы, атом комплекстин бир бөлүгү жана анын заряды көрсөтүлбөсө), сиз мындай атомдун кычкылдануу абалын аныктай аласыз. четтетүү жолу менен. Биринчиден, кошулманын ичиндеги бардык башка атомдордун зарядын аныктаңыз, андан кийин кошулманын белгилүү жалпы зарядынан бул атомдун кычкылдануу абалын эсептеңиз.
1 Кычкылдануу абалы жөнүндө катуу эрежелери жок атомдорду табыңыз. Кээ бир элементтер үчүн кычкылдануу абалын табуу боюнча эч кандай бекем эрежелер жок. Эгерде атом жогоруда саналып өткөн эрежелердин бирине да туура келбесе жана анын зарядын билбесеңиз (мисалы, атом комплекстин бир бөлүгү жана анын заряды көрсөтүлбөсө), сиз мындай атомдун кычкылдануу абалын аныктай аласыз. четтетүү жолу менен. Биринчиден, кошулманын ичиндеги бардык башка атомдордун зарядын аныктаңыз, андан кийин кошулманын белгилүү жалпы зарядынан бул атомдун кычкылдануу абалын эсептеңиз. - Мисалы, Na кошулмасында2SO4 күкүрт атомунун заряды белгисиз (S) - бул нөл эмес экенин гана билебиз, анткени күкүрт элементардык абалда эмес. Бул кошулма кычкылдануу абалын аныктоо үчүн алгебралык ыкманы көрсөтүү үчүн жакшы мисал катары кызмат кылат.
 2 Кошулмада калган элементтердин кычкылдануу абалдарын табыңыз. Жогоруда сүрөттөлгөн эрежелерди колдонуу менен кошулманын калган атомдорунун кычкылдануу абалын аныктаңыз. O, H ж.б.у.с. үчүн эрежеден четтөөлөрдү унутпаңыз.
2 Кошулмада калган элементтердин кычкылдануу абалдарын табыңыз. Жогоруда сүрөттөлгөн эрежелерди колдонуу менен кошулманын калган атомдорунун кычкылдануу абалын аныктаңыз. O, H ж.б.у.с. үчүн эрежеден четтөөлөрдү унутпаңыз. - На үчүн2SO4, эрежелерибизди колдонуп, Na ионунун заряды (демек, кычкылдануу абалы) +1, ал эми кычкылтек атомдорунун ар бири үчүн -2.
 3 Атомдордун санын кычкылдануу абалына көбөйтүңүз. Эми биз бирден башка бардык атомдордун кычкылдануу абалдарын билебиз, кээ бир элементтердин бир нече атому болушу мүмкүн экенин эске алуу керек. Ар бир элементтин атомдорунун санын (ал химиялык формулада элементтин символунан кийинки индексте көрсөтүлгөн) анын кычкылдануу абалына көбөйтөт.
3 Атомдордун санын кычкылдануу абалына көбөйтүңүз. Эми биз бирден башка бардык атомдордун кычкылдануу абалдарын билебиз, кээ бир элементтердин бир нече атому болушу мүмкүн экенин эске алуу керек. Ар бир элементтин атомдорунун санын (ал химиялык формулада элементтин символунан кийинки индексте көрсөтүлгөн) анын кычкылдануу абалына көбөйтөт. - На2SO4 бизде 2 Na атому жана 4 О атому бар. Ошентип, 2 × +1ди көбөйтүп, биз бардык Na атомдорунун (2) кычкылдануу абалына ээ болобуз, жана 4 × -2ге көбөйтүү -О (-8) атомдорунун кычкылдануу даражасын алабыз.
 4 Мурунку жыйынтыктарды кошуңуз. Көбөйтүүнүн жыйынтыгын чыгарып, кошулманын кычкылдануу абалын алабыз жок каалаган атомдун салымын эске алуу менен.
4 Мурунку жыйынтыктарды кошуңуз. Көбөйтүүнүн жыйынтыгын чыгарып, кошулманын кычкылдануу абалын алабыз жок каалаган атомдун салымын эске алуу менен. - Биздин мисалда, Na үчүн2SO4 биз 2 жана -8 кошобуз жана -6 алабыз.
 5 Кошулманын зарядынан белгисиз кычкылдануу абалын табыңыз. Сизде азыр керектүү кычкылдануу абалын оңой эсептөө үчүн бардык маалыматтар бар. Теңдеме жазыңыз, анын сол жагында мурунку эсептөө кадамында алынган сандын суммасы жана белгисиз кычкылдануу абалы жана кошулманын жалпы зарядынын оң жагында болот. Башкача айтканда, (Белгилүү кычкылдануу абалынын суммасы) + (каалаган кычкылдануу абалы) = (кошулманын заряды).
5 Кошулманын зарядынан белгисиз кычкылдануу абалын табыңыз. Сизде азыр керектүү кычкылдануу абалын оңой эсептөө үчүн бардык маалыматтар бар. Теңдеме жазыңыз, анын сол жагында мурунку эсептөө кадамында алынган сандын суммасы жана белгисиз кычкылдануу абалы жана кошулманын жалпы зарядынын оң жагында болот. Башкача айтканда, (Белгилүү кычкылдануу абалынын суммасы) + (каалаган кычкылдануу абалы) = (кошулманын заряды).- Биздин учурда, Na2SO4 чечим мындай көрүнөт:
- (Белгилүү кычкылдануу абалынын суммасы) + (каалаган кычкылдануу абалы) = (татаал заряд)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2SO4 күкүрт кычкылдануу абалына ээ 6.
- Биздин учурда, Na2SO4 чечим мындай көрүнөт:
Кеңештер
- Кошулмаларда бардык кычкылдануу абалынын суммасы зарядга барабар болушу керек. Мисалы, кошулма эки атомдуу ион болсо, атомдордун кычкылдануу абалынын суммасы жалпы иондук зарядга барабар болушу керек.
- Мезгилдик таблицаны колдоно билүү жана анда металл жана металл эмес элементтер кайда жайгашканын билүү абдан пайдалуу.
- Элементар түрүндөгү атомдордун кычкылдануу абалы дайыма нөлгө барабар. Бир иондун кычкылдануу абалы анын зарядына барабар. Суутек, литий, натрий сыяктуу мезгилдүү системанын 1А тобунун элементтери +1 кычкылдануу абалына ээ; Магний жана кальций сыяктуу 2А группасындагы металлдардын кычкылдануу абалы +2 формада. Кычкылтек менен суутек химиялык байланыштын түрүнө жараша 2 түрдүү кычкылдануу абалына ээ болушу мүмкүн.
Сага эмне керек
- Элементтердин мезгилдик системасы
- Интернетке кирүү же химия боюнча маалымдамалар
- Кагаз, калем же карандаш
- Calculator