Автор:
Frank Hunt
Жаратылган Күнү:
16 Март 2021
Жаңыртуу Күнү:
1 Июль 2024
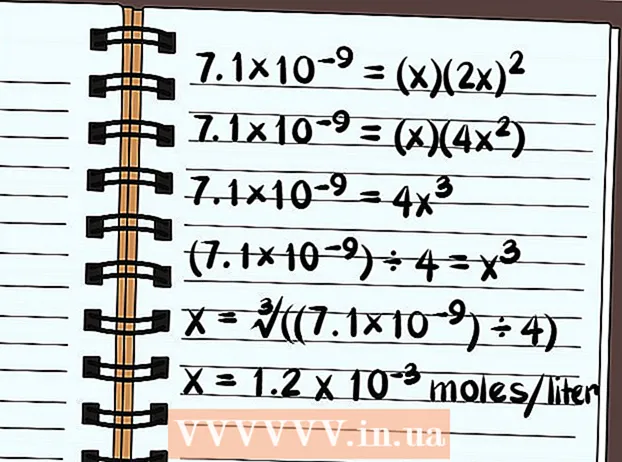
Мазмун
- Басуу
- 2-ыкманын 1-ыкмасы: Ыкчам эрежелерди колдонуу
- 2ден 2-ыкма: К-нын эригичтигин эсептөө.sp
- Зарылчылыктар
- Сунуштар
- Эскертүүлөр
Химияда эригичтик эритинген бөлүкчөлөрдү калтырбай, суюктукка аралашып, толугу менен эрий турган катуу нерсенин касиеттерин сүрөттөө үчүн колдонулат. Иондук кошулмалар гана эрийт (заряддалган). Практикалык максаттар үчүн, бир нече эрежелерди жаттап алуу же эрежелердин тизмесин карап көрүү, иондук кошулмалардын көпчүлүгү суу менен аралашканда катуу бойдон кала береби же бир кыйла көлөмдө эрийби, жокпу, билүү үчүн жетиштүү. Чындыгында, кээ бир молекулалар эч кандай өзгөрүүнү байкабасаңыз дагы, эрип кетишет, андыктан так эксперименттер үчүн бул сумманы эсептөөнү билишиңиз керек болот.
Басуу
2-ыкманын 1-ыкмасы: Ыкчам эрежелерди колдонуу
 Иондук кошулмалар жөнүндө көбүрөөк билүү. Адатта, ар бир атомдо бир нече электрон бар, бирок кээде алар бирден ашык электрон алышат же жоготушат. Натыйжа бир ион электр заряды менен. Терс заряддуу ион (ашыкча электрон) оң заряддуу ионго туш келгенде (электрон жетишпейт), алар эки магниттин терс жана оң учтары сыяктуу эле, өз ара байланышат. Натыйжада иондук байланыш пайда болот.
Иондук кошулмалар жөнүндө көбүрөөк билүү. Адатта, ар бир атомдо бир нече электрон бар, бирок кээде алар бирден ашык электрон алышат же жоготушат. Натыйжа бир ион электр заряды менен. Терс заряддуу ион (ашыкча электрон) оң заряддуу ионго туш келгенде (электрон жетишпейт), алар эки магниттин терс жана оң учтары сыяктуу эле, өз ара байланышат. Натыйжада иондук байланыш пайда болот. - Терс заряды бар иондор деп аталат аниондоржана оң заряддуу иондор катиондор.
- Адатта, атомдогу электрондордун саны электр заряддары тең салмактуулукта турган протондордун санына барабар.
 Эрий билүү. Суу молекулалары (H2O) адаттан тыш түзүлүшкө ээ, аны менен алар магнит сыяктуу жүрөт: бир учу оң зарядга ээ болсо, экинчи учу терс зарядга ээ. Иондук байланышты суу менен аралаштырганда, бул "суу магниттери" айланасында оң жана терс иондорду бөлүп алууга аракет кылышат. Айрым иондук байланыштар бири-бирине өтө бекем эмес; булар эрийтАнткени суу байланышты жулуп, эрийт. Башка композиттер күчтүү байланыштарга ээ жана бар Чечүүчү эмесанткени алар суу молекулаларына карабастан бири-бирине жабыша алышат.
Эрий билүү. Суу молекулалары (H2O) адаттан тыш түзүлүшкө ээ, аны менен алар магнит сыяктуу жүрөт: бир учу оң зарядга ээ болсо, экинчи учу терс зарядга ээ. Иондук байланышты суу менен аралаштырганда, бул "суу магниттери" айланасында оң жана терс иондорду бөлүп алууга аракет кылышат. Айрым иондук байланыштар бири-бирине өтө бекем эмес; булар эрийтАнткени суу байланышты жулуп, эрийт. Башка композиттер күчтүү байланыштарга ээ жана бар Чечүүчү эмесанткени алар суу молекулаларына карабастан бири-бирине жабыша алышат. - Кээ бир байланыштар ички байланыштарга ээ, аларды суунун тартылуу күчүнө салыштырууга болот. Бул заттар орточо эрийт, анткени байланыштардын бир кыйла бөлүгү (бирок бардыгы эмес) бөлүнөт.
 Эригичтик эрежелерин үйрөнүңүз. Атомдордун өз ара аракети бир топ татаал болгондуктан, кайсы кошулмалар эрийт жана эрий албайт. Төмөнкү тизмедеги кошулмадан биринчи ионду табыңыз, ал адатта кандай иштээрин билип алыңыз, андан кийин экинчи ион анормалдуу иштебей тургандыгын текшерип, өзгөчө учурларды текшериңиз.
Эригичтик эрежелерин үйрөнүңүз. Атомдордун өз ара аракети бир топ татаал болгондуктан, кайсы кошулмалар эрийт жана эрий албайт. Төмөнкү тизмедеги кошулмадан биринчи ионду табыңыз, ал адатта кандай иштээрин билип алыңыз, андан кийин экинчи ион анормалдуу иштебей тургандыгын текшерип, өзгөчө учурларды текшериңиз. - Мисалы, стронций хлоридин (SrCl) колдонуу үчүн2), төмөндө көрсөтүлгөн тайманбас кадамдардан Sr же Cl изде. Cl "негизинен чечилүүчү", андыктан төмөндөгү өзгөчө учурларды текшериңиз. Sr өзгөчө учур катары көрсөтүлгөн эмес, ошондуктан SrCl2 эрийт
- Ар бир эрежеге мүнөздүү өзгөчө учурлар төмөндө келтирилген. Башка өзгөчөлүктөр бар, бирок аларды кадимки химия сабагында же лабораториясында таба албасаңыз керек.
 Курамында щелочтуу металлдар, анын ичинде Li, Na, K, Rb жана Cs болгондо эрийт. Булар дагы IA тобунун элементтери деп аталат: литий, натрий, калий, рубидий жана цезий. Ушул иондордун бардыгы менен дээрлик бардык кошулмалар эрийт.
Курамында щелочтуу металлдар, анын ичинде Li, Na, K, Rb жана Cs болгондо эрийт. Булар дагы IA тобунун элементтери деп аталат: литий, натрий, калий, рубидий жана цезий. Ушул иондордун бардыгы менен дээрлик бардык кошулмалар эрийт. - Өзгөчө кырдаал: Li3PO4 эрибейт.
 NO менен кошулмалар3, C2H.3O2, ЖОК2, ClO3 жана ClO4 эрийт. Булар тиешелүүлүгүнө жараша нитрат, ацетат, нитрит, хлорат жана перхлорат иондору. Ацетаттын көбүнчө OAc менен кыскартылаарын эске алыңыз.
NO менен кошулмалар3, C2H.3O2, ЖОК2, ClO3 жана ClO4 эрийт. Булар тиешелүүлүгүнө жараша нитрат, ацетат, нитрит, хлорат жана перхлорат иондору. Ацетаттын көбүнчө OAc менен кыскартылаарын эске алыңыз. - Өзгөчө кырдаалдар: Ag (OAc) (күмүш ацетаты) жана Hg (OAc)2 (сымап ацетаты) эрибейт.
- AgNO2 жана KClO4 "жарым-жартылай эрийт".
 Cl, Br жана I кошулмалары көбүнчө эрийт. Хлорид, бромид жана иодид иондору дээрлик ар дайым галоген туздары деп аталган эрүүчү кошулмаларды пайда кылат.
Cl, Br жана I кошулмалары көбүнчө эрийт. Хлорид, бромид жана иодид иондору дээрлик ар дайым галоген туздары деп аталган эрүүчү кошулмаларды пайда кылат. - Өзгөчө кырдаал: Эгерде алардын бири күмүш (Ag), сымап (Hg.) Иондору менен байланышса2), же коргошун (Pb), натыйжасы эрий албайт. Жез (Cu) жана таллий (Tl) менен азыраак кездешүүчү бирикмелерге да тиешелүү.
 SO менен байланышуу4 адатта эрийт. Сульфат иону көбүнчө эрүүчү кошулмаларды пайда кылат, бирок бир нече өзгөчөлүктөр бар.
SO менен байланышуу4 адатта эрийт. Сульфат иону көбүнчө эрүүчү кошулмаларды пайда кылат, бирок бир нече өзгөчөлүктөр бар. - Өзгөчө кырдаалдар: Сульфат иону төмөнкү иондор менен эрий турган бирикмелерди түзөт: стронций Sr, барий Ba, коргошун Pb, күмүш Ag, кальций Ca, радий Ra жана диатомиялык күмүш Ag2. Күмүш сульфаты жана кальций сульфаты эрий тургандыгын эске алсак, кээде өтө эрийт.
 OH же S кошулмалары эрий албайт. Булар тиешелүүлүгүнө жараша гидроксид жана сульфид иондору.
OH же S кошулмалары эрий албайт. Булар тиешелүүлүгүнө жараша гидроксид жана сульфид иондору. - Өзгөчө кырдаалдар: Шелочтуу металлдар (I-A тобу) жана алар эрибей турган бирикмелерди түзүүнү канчалык жакшы көрөрү эсиңиздеби? Li, Na, K, Rb жана Cs гидроксид же сульфид иондору менен эрий турган бирикмелерди түзөт. Мындан тышкары, гидроксид жердеги щелочтуу металлдар (II-А тобу) иондору менен эрий турган туздарды түзөт: кальций Са, стронций Sr жана барий Ба. Жердин щелочтуу кошулмасы бар гидроксиддин биригишине жетиштүү молекулалар бар экендигин, кээде "өтө эрийт" деп эсептешет.
 CO менен кошулмалар3 же PO4 эрибейт. Карбонат жана фосфат иондорун акыркы жолу текшерип көрүңүз, ошондо кошулмадан эмнени күтөрүңүздү билишиңиз керек.
CO менен кошулмалар3 же PO4 эрибейт. Карбонат жана фосфат иондорун акыркы жолу текшерип көрүңүз, ошондо кошулмадан эмнени күтөрүңүздү билишиңиз керек. - Өзгөчө кырдаалдар: Бул иондор кадимки заттар, Li, Na, K, Rb жана Cs щелочтуу металлдары, ошондой эле аммоний NH менен эрий турган бирикмелерди түзөт.4.
2ден 2-ыкма: К-нын эригичтигин эсептөө.sp
 К константасынын эрүүчүлүк көбөйтүмүн изде.sp. Бул туруктуу ар бир туташуу үчүн ар башка, андыктан аны окуу китебиндеги таблицадан же Интернеттен издеш керек. Бул баалуулуктар эксперименталдык жол менен аныкталгандыктан, алар ар кандай таблицада ар кандай болушу мүмкүн, андыктан эгер бар болсо, анда окуу китебиңиздеги таблицаны колдонгонуңуз оң. Эгерде башкасы белгиленбесе, көпчүлүк таблицаларда айлана чөйрөнүн температурасы 25o C болот.
К константасынын эрүүчүлүк көбөйтүмүн изде.sp. Бул туруктуу ар бир туташуу үчүн ар башка, андыктан аны окуу китебиндеги таблицадан же Интернеттен издеш керек. Бул баалуулуктар эксперименталдык жол менен аныкталгандыктан, алар ар кандай таблицада ар кандай болушу мүмкүн, андыктан эгер бар болсо, анда окуу китебиңиздеги таблицаны колдонгонуңуз оң. Эгерде башкасы белгиленбесе, көпчүлүк таблицаларда айлана чөйрөнүн температурасы 25o C болот. - Мисалы, сиз коргошун йодидин (PbI) эритүүнү кааласаңыз2), эригичтик өнүмүнүн тең салмактуулук константасын жаз. Эгерде сиз bilbo.chm.uri.edu үстөлүн колдонуп жатсаңыз, анда 7.1 × 10 туруктуу көлөмүн колдонуңуз.
 Алгач, химиялык теңдемени жазып алыңыз. Алгач, кошулма эригенде кандайча ионго бөлүнөөрүн аныктаңыз. Эми К менен теңдеме жаз.sp бир жагынан, ал эми экинчи жагынан жеке иондор.
Алгач, химиялык теңдемени жазып алыңыз. Алгач, кошулма эригенде кандайча ионго бөлүнөөрүн аныктаңыз. Эми К менен теңдеме жаз.sp бир жагынан, ал эми экинчи жагынан жеке иондор. - Мисалы, PbI молекуласы2 Pb, I жана башка I иондоруна бөлүнөт (бир иондун зарядын билүү же издөө гана керек, анткени жалпы кошулманын ар дайым нейтралдуу заряды бар экендигин билесиң).
- 7.1 × 10 = [Pb] [I] теңдемесин жазыңыз
 Өзгөрмөлөрдү колдонуу үчүн теңдемени жөндөңүз. Молекулалардын же иондордун саны жөнүндө билимиңизди колдонуп, теңдемени бирдиктүү алгебра маселеси катары жазыңыз. Эритинүүчү заттын өлчөмүнө барабар х коюп, ар бир иондун сандары катары өзгөрүлмөчөлөрдү х деп эсептеп жазыңыз.
Өзгөрмөлөрдү колдонуу үчүн теңдемени жөндөңүз. Молекулалардын же иондордун саны жөнүндө билимиңизди колдонуп, теңдемени бирдиктүү алгебра маселеси катары жазыңыз. Эритинүүчү заттын өлчөмүнө барабар х коюп, ар бир иондун сандары катары өзгөрүлмөчөлөрдү х деп эсептеп жазыңыз. - Биздин мисалда 7.1 × 10 = [Pb] [I] деп жазып жатабыз
- Кошулмада бир гана коргошун иону (Pb) болгондуктан, эриген кошулма молекулаларынын саны эркин коргошун иондорунун санына барабар болот. Ошентип, [Pb] ды x менен алмаштыра алабыз.
- Ар бир коргошун ионуна эки йод иону (I) туура келгендиктен, йод атомдорунун санын 2хге теңей алабыз.
- Эми теңдеме 7.1 × 10 = (x) (2x) окуйт
 Бар болсо, жалпы иондорду карап көрөлү. Эгерде кошулманы таза сууда эритип жаткан болсоңуз, бул кадамды өткөрүп жиберип коюңуз. Бирок, эгерде кошулма курамында бир же бир нече түзүүчү иондор ("жалпы ион") бар эритмеде эритилген болсо, анда эригичтиги кыйла төмөндөйт. Кадимки иондордун таасири көбүнчө эрибеген бирикмелерде байкалат жана бул учурларда тең салмактуулуктагы иондордун басымдуу бөлүгү эритмеде бар иондон келип чыгат деп божомолдоого болот. Эритмеге кирген иондордун белгилүү молярдык концентрациясы (бир литрге моль же М) менен теңдемени кайра жазыңыз, ошол ион үчүн колдонулган х маанисин алмаштырыңыз.
Бар болсо, жалпы иондорду карап көрөлү. Эгерде кошулманы таза сууда эритип жаткан болсоңуз, бул кадамды өткөрүп жиберип коюңуз. Бирок, эгерде кошулма курамында бир же бир нече түзүүчү иондор ("жалпы ион") бар эритмеде эритилген болсо, анда эригичтиги кыйла төмөндөйт. Кадимки иондордун таасири көбүнчө эрибеген бирикмелерде байкалат жана бул учурларда тең салмактуулуктагы иондордун басымдуу бөлүгү эритмеде бар иондон келип чыгат деп божомолдоого болот. Эритмеге кирген иондордун белгилүү молярдык концентрациясы (бир литрге моль же М) менен теңдемени кайра жазыңыз, ошол ион үчүн колдонулган х маанисин алмаштырыңыз. - Мисалы, биздин коргошун-йод кошулмасы 0,2 М коргошун хлориди (PbCl) камтылган эритмеде эритилген болсо2), анда биз 7.1 × 10 = (0.2M + x) (2x) деп теңдемени кайра жаза алабыз. Андан кийин, 0.2M концентрациясы х-га караганда жогору болгондуктан, биз аны 7.1 × 10 = (0.2M) (2x) деп кайрадан жазсак болот.
 Теңдемени чечүү. Х үчүн эритүү жана кошулманын канчалык эрий тургандыгын билүү. Эригичтик константасын аныктоо ыкмасынан улам, сиздин жообуңуз бир литр сууга эриген кошулманын молунун саны катары көрсөтүлөт. Акыркы жоопту табуу үчүн сизге калькулятор керек болушу мүмкүн.
Теңдемени чечүү. Х үчүн эритүү жана кошулманын канчалык эрий тургандыгын билүү. Эригичтик константасын аныктоо ыкмасынан улам, сиздин жообуңуз бир литр сууга эриген кошулманын молунун саны катары көрсөтүлөт. Акыркы жоопту табуу үчүн сизге калькулятор керек болушу мүмкүн. - Төмөндө жалпы иондор менен эмес, таза сууда эригичтикке тиешелүү.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7.1 × 10 = 4x
- (7,1 × 10) ÷ 4 = х
- x = ∛ ((7.1 × 10) ÷ 4)
- x = Литри 1,2 х 10 моль эрийт. Бул өтө аз өлчөм, ошондуктан бул кошулма негизинен начар эрий тургандыгын билесиз.
Зарылчылыктар
- Эригичтүүлүк продуктуларынын туруктуу таблицасы (К.sp) байланыштар үчүн.
Сунуштар
- Эгерде сизде кошулманын канчалык деңгээлде эрий тургандыгы жөнүндө тажрыйбалардан алынган маалыматтар болсо, анда ошол эле теңдемени колдонуп, эригичтик константасын чечсеңиз болотsp.
Эскертүүлөр
- Бул терминдердин жалпы кабыл алынган аныктамасы жок, бирок химиктер көпчүлүк кошулмаларга макул. Эритилген жана эрий элек молекулалардын олуттуу үлүшү бар кошулмаларга байланыштуу кээ бир чектик учурларды ар кандай эригичтик таблицалары менен сүрөттөөгө болот.
- Айрым эски окуу китептери NH берет4OH кайрадан эрий турган курамы катары. Бул туура эмес; аз өлчөмдө NH4 жана OH иондорун байкоого болот, бирок аларды бөлүп, кошулманы түзүүгө болбойт.