Автор:
Helen Garcia
Жаратылган Күнү:
17 Апрель 2021
Жаңыртуу Күнү:
1 Июль 2024
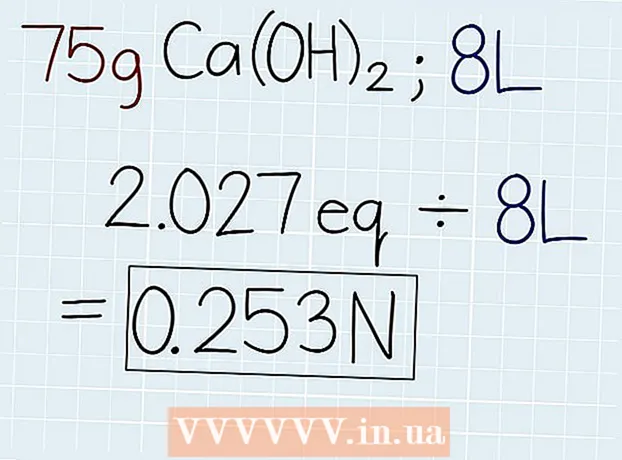
Мазмун
- Кадамдар
- Метод 1 2: Молярдуулук аркылуу Нормалдуулукту Эсептөө
- Метод 2 2: Эквиваленттүү массада нормалдуулукту эсептөө
- Кеңештер
- Сага эмне керек
Нормалдуулук эритмеде кислотанын же щелочтун концентрациясын көрсөтөт. Эритменин нормалдуулугун билүү үчүн молярдыкты да, молекуланын эквивалент массасын да эсептөөлөрдө колдонсо болот. Эгерде сиз молярдыкты колдонууну тандасаңыз, N = M (n) формуласын колдонуңуз, мында M - молярдык, n - суутек же гидроксид молекулаларынын саны. Эгерде сиз эквиваленттүү массаны колдонууну чечсеңиз, N = eq ÷ V формуласын колдонуңуз, мында eq - эквиваленттердин саны, V - эритменин көлөмү.
Кадамдар
Метод 1 2: Молярдуулук аркылуу Нормалдуулукту Эсептөө
 1 Эритменин бардык компоненттеринин молярдык массасын кошуңуз. Химиялык формуланын элементтерин молярдык массага туура келген атомдук массасын билүү үчүн периоддук системадан табыңыз. Ар бир элементтин молярдык массасын жазыңыз жана аны ошол элементтердин санына көбөйтүңүз. Бардык молярдык массаны табуу үчүн бардык компоненттердин молярдык массасын кошуңуз.
1 Эритменин бардык компоненттеринин молярдык массасын кошуңуз. Химиялык формуланын элементтерин молярдык массага туура келген атомдук массасын билүү үчүн периоддук системадан табыңыз. Ар бир элементтин молярдык массасын жазыңыз жана аны ошол элементтердин санына көбөйтүңүз. Бардык молярдык массаны табуу үчүн бардык компоненттердин молярдык массасын кошуңуз. - Мисалы, күкүрт кислотасынын молярдык массасын билгиңиз келсе (H2SO4), суутектин (1 г), күкүрттүн (3 г) жана кычкылтектин (16 г) молярдык массасын билип алыңыз.
- Массаны курамдагы компоненттердин санына көбөйтүңүз. Биздин мисалда 2 суутек атому жана 4 кычкылтек атому бар. Водороддун жалпы молярдык массасы 2 x 1 g = 2 g Бул эритмедеги кычкылтектин молярдык массасы 4 x 16 g = 64 г болот.
- Бардык молярдык массаларды кошуңуз. Сиз 2 г + 32 г + 64 г = 98 г / моль аласыз.
- Эгерде сиз издеп жаткан чечимдин молярдуулугун мурунтан эле билсеңиз, түздөн -түз 4 -кадамга өтүңүз.
 2 Эритменин чыныгы массасын молярдык массага бөлүңүз. Чечимдин чыныгы салмагын билип алыңыз. Бул эритмеси бар контейнерде же тапшырманын өзүндө көрсөтүлөт.Андан кийин эритменин массасын мурда табылган жалпы молярдык массага бөлүңүз. Натыйжада эритмендеги молдердин саны болот, андан кийин "мең" жазылышы керек.
2 Эритменин чыныгы массасын молярдык массага бөлүңүз. Чечимдин чыныгы салмагын билип алыңыз. Бул эритмеси бар контейнерде же тапшырманын өзүндө көрсөтүлөт.Андан кийин эритменин массасын мурда табылган жалпы молярдык массага бөлүңүз. Натыйжада эритмендеги молдердин саны болот, андан кийин "мең" жазылышы керек. - Мисалы, эгерде сиз 100 г H нормалдуу экенин билүүгө аракет кылып жатсаңыз2SO412 литр суюктукта ээрип, чыныгы массаны колдонуңуз жана молярга бөлүңүз. Натыйжада, сиз аласыз: 100 г ÷ 98 г / моль = 1,02 моль.
- 1 мол 6.02 x 10 атомго же эритменин молекулаларына барабар.
 3 Молярдуулукту билүү үчүн натыйжаны эритменин көлөмүнө литрге бөлүңүз. Жаңы эле эсептелген эритмендеги моль санын алып, өлчөнө турган эритменин жалпы көлөмүнө бөлүңүз. Натыйжада, сиз эритменин концентрациясын биле турган молярдыкты (M) билесиз.
3 Молярдуулукту билүү үчүн натыйжаны эритменин көлөмүнө литрге бөлүңүз. Жаңы эле эсептелген эритмендеги моль санын алып, өлчөнө турган эритменин жалпы көлөмүнө бөлүңүз. Натыйжада, сиз эритменин концентрациясын биле турган молярдыкты (M) билесиз. - Биздин мисалга таянып, биз төмөнкү формуланы алабыз: 1,02 моль ÷ 12 L = 0,085 М.
Кеңеш: эритменин көлөмүн литрге айландырууну унутпаңыз, эгер сиз буга чейин мындай кыла элек болсоңуз. Болбосо, сиз туура эмес жооп аласыз.
 4 Водород же гидроксид молекулаларынын санына молярдыкты көбөйткүлө. Химиялык формуланы карап, кислотадагы суутек атомдорунун (H) же (OH) гидроксид молекулаларынын санын билиңиз. Андан кийин, эритменин молярдуулугун нормалдуу концентрацияны же нормалдуулукту табуу үчүн, бул эритмедеги суутектин же гидроксид молекулаларынын санына көбөйтүңүз. Жообуңуздун аягында "N" деген аббревиатураны жазыңыз.
4 Водород же гидроксид молекулаларынын санына молярдыкты көбөйткүлө. Химиялык формуланы карап, кислотадагы суутек атомдорунун (H) же (OH) гидроксид молекулаларынын санын билиңиз. Андан кийин, эритменин молярдуулугун нормалдуу концентрацияны же нормалдуулукту табуу үчүн, бул эритмедеги суутектин же гидроксид молекулаларынын санына көбөйтүңүз. Жообуңуздун аягында "N" деген аббревиатураны жазыңыз. - Биздин мисалда күкүрт кислотасы (H2SO4) 2 суутек атому. Ошентип формула мындай болот: 0.085 M x 2 = 0.17 Н.
- Башка мисалда, молярлуулугу 2 М болгон натрий гидроксиди (NaOH) 1 гана гидроксид молекуласына ээ. Демек, формула төмөнкүдөй болот: 2 M x 1 = 2 N.
Метод 2 2: Эквиваленттүү массада нормалдуулукту эсептөө
 1 Эритменин жалпы молярдык массасын билип алыңыз. Эритменин химиялык формуласын карап көрүңүз жана ар бир элементти мезгилдик таблицадан табыңыз. Ар бир элементтин молярдык массасын жазыңыз жана формулада ошол элементтердин санына көбөйтүңүз. Бардык молярдык массаларды кошуп, граммдын жалпы молярдык массасын табыңыз.
1 Эритменин жалпы молярдык массасын билип алыңыз. Эритменин химиялык формуласын карап көрүңүз жана ар бир элементти мезгилдик таблицадан табыңыз. Ар бир элементтин молярдык массасын жазыңыз жана формулада ошол элементтердин санына көбөйтүңүз. Бардык молярдык массаларды кошуп, граммдын жалпы молярдык массасын табыңыз. - Мисалы, эгер сиз Ca молярдык массасын билгиңиз келсе (OH)2, анда кальцийдин (40 г), кычкылтектин (16 г) жана суутектин (1 г) молярдык массасын билип алыңыз.
- Формулада кычкылтек менен суутектин 2 атому бар. Кычкылтектин жалпы массасы: 2 x 16 g = 32 г болот. Водороддун молярдык массасы: 2 x 1 g = 2 g болот.
- 40 г + 32 г + 2 г = 74 г / моль алуу үчүн бардык молярдык массаларды кошуңуз.
 2 Молярдык массаны суутектин же гидроксид молекулаларынын санына бөлүңүз. Негиздеги кислота же гидроксид (OH) молекулаларындагы суутек атомдорунун (H) санын билип алыңыз. Жаңы алынган жалпы молярдык массаны атомдордун же молекулалардын санына бөлүп, 1 эквиваленттин салмагын табыңыз, ал 1 моль суутектин же гидроксиддин массасына барабар болот. Жооптун аягында эквиваленттин массасын билдирген "G.-e." аббревиатурасын жазыңыз.
2 Молярдык массаны суутектин же гидроксид молекулаларынын санына бөлүңүз. Негиздеги кислота же гидроксид (OH) молекулаларындагы суутек атомдорунун (H) санын билип алыңыз. Жаңы алынган жалпы молярдык массаны атомдордун же молекулалардын санына бөлүп, 1 эквиваленттин салмагын табыңыз, ал 1 моль суутектин же гидроксиддин массасына барабар болот. Жооптун аягында эквиваленттин массасын билдирген "G.-e." аббревиатурасын жазыңыз. - Биздин мисалда, Ca (OH)2 2 эки суутек молекуласы, бул эквиваленттин массасы 74 г / мол ÷ 2 = 37 G.-e.
 3 Эритменин чыныгы салмагын эквиваленттүү салмакка бөлүңүз. Эквиваленттин массасын билгенден кийин, аны эритмеси бар идиште же чечилип жаткан маселеде көрсөтүлгөн эритменин массасына бөл. Жооп эритмедеги эквиваленттердин саны болот, ошондо сиз нормалдуулукту эсептей аласыз. Жооптун аягында "e" деген аббревиатураны коюңуз.
3 Эритменин чыныгы салмагын эквиваленттүү салмакка бөлүңүз. Эквиваленттин массасын билгенден кийин, аны эритмеси бар идиште же чечилип жаткан маселеде көрсөтүлгөн эритменин массасына бөл. Жооп эритмедеги эквиваленттердин саны болот, ошондо сиз нормалдуулукту эсептей аласыз. Жооптун аягында "e" деген аббревиатураны коюңуз. - Эгерде биздин мисалда 75 г Ca (OH)2, анда формула мындай болот: 75 g ÷ 37 G.-e = 2.027 Oe.
 4 Эквиваленттердин санын эритменин көлөмүнө литрге бөлгүлө. Чечимдин жалпы көлөмүн билип, жоопту литр менен жазыңыз. Жаңы эле алынган эквиваленттердин санын алып, ченемдүүлүктү билүү үчүн эритменин көлөмүнө бөлүңүз. Жообуңуздун аягына "N" деген аббревиатура коюңуз.
4 Эквиваленттердин санын эритменин көлөмүнө литрге бөлгүлө. Чечимдин жалпы көлөмүн билип, жоопту литр менен жазыңыз. Жаңы эле алынган эквиваленттердин санын алып, ченемдүүлүктү билүү үчүн эритменин көлөмүнө бөлүңүз. Жообуңуздун аягына "N" деген аббревиатура коюңуз. - Эгерде көлөмү 8 литр болгон эритмеде 75 г Ca (OH) болсо2, андан кийин эквиваленттердин санын көлөмгө төмөнкүчө бөлүңүз: 2.027 Oe. ÷ 8 л = 0,253 Н.
Кеңештер
- Кадимки концентрация же нормалдуулук адатта кислоталарды жана негиздерди өлчөө үчүн колдонулат. Эгер башка эритменин концентрациясын аныктоо керек болсо, бул көбүнчө молярдыкты өлчөө жолу менен жасалат.
Сага эмне керек
- Мезгилдик таблица
- Calculator