Автор:
Florence Bailey
Жаратылган Күнү:
21 Март 2021
Жаңыртуу Күнү:
1 Июль 2024
Мазмун
- Кадамдар
- 2 -метод 1: D. I. Менделеевдин мезгилдик системасын колдонуу менен электрондарды бөлүштүрүү
- Метод 2 2: ADOMAH мезгилдик таблицасын колдонуу
- Кеңештер
Электрондук конфигурация атом - анын электрон орбиталынын сандык көрүнүшү. Электрондук орбитальдар - атом ядросунун тегерегинде жайгашкан, математикалык жактан ыктымалдуу болгон ар кандай формадагы аймактар. Электрондук конфигурация окурманга атомдун канча электрон орбиталы бар экенин айтууга, ошондой эле ар бир орбиталдагы электрондун санын аныктоого жардам берет. Бул макаланы окугандан кийин, сиз электрондук конфигурацияларды түзүү ыкмасын өздөштүргөн болосуз.
Кадамдар
2 -метод 1: D. I. Менделеевдин мезгилдик системасын колдонуу менен электрондарды бөлүштүрүү
 1 Атомуңуздун атомдук номерин табыңыз. Ар бир атомдун аны менен байланышкан белгилүү бир электрон саны бар. Мезгилдик таблицадан атомуңуздун символун табыңыз. Атомдук номер 1ден башталган оң бүтүн сан (суутек үчүн) жана ар бир кийинки атом үчүн бирден көбөйөт. Атомдук номер - бул атомдогу протондордун саны, демек, бул да заряды нөлгө барабар болгон атомдордун саны.
1 Атомуңуздун атомдук номерин табыңыз. Ар бир атомдун аны менен байланышкан белгилүү бир электрон саны бар. Мезгилдик таблицадан атомуңуздун символун табыңыз. Атомдук номер 1ден башталган оң бүтүн сан (суутек үчүн) жана ар бир кийинки атом үчүн бирден көбөйөт. Атомдук номер - бул атомдогу протондордун саны, демек, бул да заряды нөлгө барабар болгон атомдордун саны. - 2 Атомдун зарядын аныктаңыз. Нейтралдуу атомдор мезгилдик таблицада көрсөтүлгөндөй электронго ээ болот. Бирок, заряддалган атомдор заряддын өлчөмүнө жараша көп же азыраак электронго ээ болот. Эгерде сиз заряддалган атом менен иштеп жатсаңыз, анда электрондарды төмөндөгүдөй кошуңуз же алып салыңыз: ар бир терс зарядга бир электрон кошуп, ар бир позитивдүүгө бирди алып салыңыз.
- Мисалы, заряды -1 болгон натрий атомунда кошумча электрон болот кошумча анын атомдук номери 11. Башкача айтканда, жалпы атомдо 12 электрон болот.
- Эгерде биз +1 заряды бар натрий атому жөнүндө сөз кыла турган болсок, анда бир электрон базалык атомдук номер 11ден алынып салынышы керек. Ошентип, атомдо 10 электрон болот.
- 3 Орбиталдардын негизги тизмесин унутпаңыз. Электрондордун саны көбөйгөн сайын, алар белгилүү бир ырааттуулукка ылайык атомдун электрон кабыгынын ар кандай деңгээлдерин толтурушат. Электрондук кабыкчанын ар бир деңгээлинде толтурулганда жуп сандагы электрон бар. Төмөнкү деңгээлдер бар:
- s-sublevel ("s" тамгасынан мурун келген электрондук конфигурациядагы каалаган сан) бир орбиталды камтыйт жана ылайык Паулинин принциби, бир орбитал максимум 2 электронду камтышы мүмкүн, андыктан, электрон кабыгынын ар бир суб-деңгээлинде 2 электрон болушу мүмкүн.
- p-sublevel 3 орбиталды камтыйт, демек, максимум 6 электронду камтышы мүмкүн.
- d-sublevel 5 орбиталды камтыйт, андыктан 10 электронго чейин болушу мүмкүн.
- f-sublevel 7 орбиталды камтыйт, андыктан 14 электронго чейин болушу мүмкүн.
- g-, h-, i- жана k-sublevels теориялык болуп саналат. Бул орбиталдарда электрону бар атомдор белгисиз. G-sublevel 9 орбиталды камтыйт, ошондуктан теориялык жактан 18 электронго ээ болушу мүмкүн. H-sublevel 11 орбитал жана эң көп 22 электрон болушу мүмкүн; i -sublevelде -13 орбитал жана эң көбү 26 электрон; k -сублевелинде - 15 орбиталь жана эң көбү 30 электрон.
- Мнемоникалык трюкту колдонуу менен орбиталдардын тартибин жаттаңыз:
С.ober Пhysicists Dжок Fинд Г.ирафалар Hиштөө Менп К.itchens (акылдуу физиктер ашканада жашынган жирафтарды табышпайт).
- 4 Электрондук конфигурация жазуусун түшүнүңүз. Электрондук конфигурациялар ар бир орбиталдагы электрондордун санын так чагылдыруу үчүн жазылган. Орбиталдар ырааттуу түрдө жазылат, ар бир орбиталдагы атомдордун саны орбиталык аталыштын оң жагына жазылат. Толтурулган электрондук конфигурация төмөнкү деңгээлдеги белгилөөлөрдүн жана жогорку жазуулардын ырааттуулугу түрүндө болот.
- Мисалы, эң жөнөкөй электрондук конфигурация: 1s 2s 2p. Бул конфигурация 1s сублевелинде эки электрон, 2s sublevelде эки электрон жана 2p sublevelде алты электрон бар экенин көрсөтөт. 2 + 2 + 6 = бардыгы 10 электрон. Бул нейтралдуу неон атомунун электрондук конфигурациясы (неон атомдук номери 10).
- 5 Орбиталдардын тартибин унутпаңыз. Электрон орбиталдары электрон катмарынын санынын өсүү тартибинде, бирок энергиянын өсүү тартибинде номерленгенин унутпаңыз. Мисалы, толтурулган 4s орбиталы жарым -жартылай толтурулган же толтурулган 3dге караганда азыраак энергиялуу (же азыраак мобилдүү), ошондуктан 4s орбиталы биринчи жазылат. Орбиталдардын тартибин билгенден кийин, аларды атомдогу электрондордун санына жараша оңой толтура аласыз. Орбиталдарды толтуруу тартиби төмөнкүчө: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Бардык орбиталдар толтурулган атомдун электрондук конфигурациясы төмөнкүдөй формада болот: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Белгилей кетчү нерсе, бардык орбитальдар толтурулганда, Uuo (ununoctium) 118 элементинин электрондук конфигурациясы, мезгилдик таблицанын эң чоң номери бар атом. Ошондуктан, бул электрондук конфигурация нейтралдуу заряддалган атомдун азыркы учурда белгилүү болгон бардык электрондук деңгээлдерин камтыйт.
- 6 Орбиталдарды атомуңуздагы электрондордун санына жараша толтуруңуз. Мисалы, эгерде биз нейтралдуу кальций атомунун электрондук конфигурациясын жазгыбыз келсе, анда анын атомдук номерин мезгилдик таблицадан издеп баштообуз керек. Анын атомдук номери 20, ошондуктан 20 электрону бар атомдун конфигурациясын жогорудагы тартипке ылайык жазабыз.
- Орбиталдарды жыйырмачы электронго жеткенге чейин жогорудагы тартипте толтуруңуз. Биринчи 1с орбиталында эки электрон болот, 2с орбиталдарында дагы эки болот, 2p - алты, 3s - эки, 3p - 6 жана 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20.) башкача айтканда, кальцийдин электрондук конфигурациясы: 1s 2s 2p 3s 3p 4s.
- Орбитальдар энергиянын өсүү тартибинде экенин эске алыңыз. Мисалы, сиз 4 -энергетикалык деңгээлге өтүүгө даяр болгондо, адегенде 4s орбиталын жазыңыз, жана анда 3d. Төртүнчү энергетикалык деңгээлден кийин, сиз дагы ошол эле тартип кайталанган бешинчисине барасыз. Бул үчүнчү энергия деңгээлинен кийин гана болот.
- 7 Мезгилдик таблицаны визуалдык маалымат катары колдонуңуз. Сиз, балким, мезгилдик таблицанын формасы электрондук конфигурациядагы электрондук сублевелдердин тартибине туура келерин байкагандырсыз. Мисалы, сол жактагы экинчи тилкедеги атомдор ар дайым "с" менен бүтөт, ал эми ичке ортоңку бөлүктүн оң четиндеги атомдор дайыма "d" менен бүтөт ж.б.у.с. Мезгилдик таблицаны конфигурацияларды жазуу үчүн визуалдык колдонмо катары колдонуңуз - орбитальдарга кошуу тартиби столдогу позицияңызга туура келет. Төмөндө караңыз:
- Тактап айтканда, эң сол жактын эки колоннасында электрондук конфигурациялары s-орбиталдар менен аяктаган атомдор бар, столдун оң блогунда конфигурациялары p-орбиталдар менен бүткөн атомдор бар, ал эми төмөнкү бөлүгүндө атомдор f-орбиталдарда бүтөт.
- Мисалы, хлордун электрондук конфигурациясын жазып жатканда, мындай ойлон: "Бул атом периоддук системанын үчүнчү катарында (же" периодунда ") жайгашкан. Ал ошондой эле p орбиталдык блоктун бешинчи тобунда жайгашкан. Мезгилдик системанын .. Демек, анын электрондук конфигурациясы ..3p менен аяктайт
- Көңүл буруңуз: столдун d жана f орбитальдарынын аймагындагы элементтер, алар жайгашкан мезгилге туура келбеген энергия деңгээлдери менен мүнөздөлөт. Мисалы, d-орбитальдары бар элементтер блогунун биринчи сабы 3d орбитальдарга туура келет, бирок ал 4-мезгилде жайгашкан, жана f-орбитальдары бар элементтердин биринчи катары 4f орбиталына туура келет. 6 -мезгилде турат.
- 8 Узун электрондук конфигурацияларды жазуунун стенографиясын үйрөнүңүз. Мезгилдик системанын оң четиндеги атомдор деп аталат асыл газдар. Бул элементтер химиялык жактан абдан туруктуу. Узун электрондук конфигурацияларды жазуу процессин кыскартуу үчүн, чарчы кашаанын ичине атомуңузга караганда электрону аз болгон эң жакын асыл газдын химиялык символун жазыңыз, андан кийин кийинки орбиталык деңгээлдеги электрондук конфигурацияны жазууну улантыңыз. Төмөндө караңыз:
- Бул түшүнүктү түшүнүү үчүн конфигурация мисалын жазуу пайдалуу. Цинктин конфигурациясын (атомдук номери 30) асыл газ аббревиатурасын колдонуп жазалы. Толук цинк конфигурациясы мындай көрүнөт: 1s 2s 2p 3s 3p 4s 3d. Бирок, биз 1s 2s 2p 3s 3p аргондун электрондук конфигурациясы экенин көрөбүз, асыл газ. Цинктин электрондук конфигурация бөлүгүн чарчы кашаанын ичиндеги аргон химиялык белгиси менен алмаштырыңыз ([Ar].)
- Ошентип, кыскартылган түрдө жазылган цинктин электрондук конфигурациясы: [Ar] 4s 3d.
- Көңүл буруңуз, эгер сиз асыл газдын электрондук конфигурациясын жазып жатсаңыз, аргон деп айтыңыз, сиз [Ar] жаза албайсыз! Бул элементтин алдында турган асыл газдын азайышын колдонуу керек; аргон үчүн неон болот ([Не]).
Метод 2 2: ADOMAH мезгилдик таблицасын колдонуу
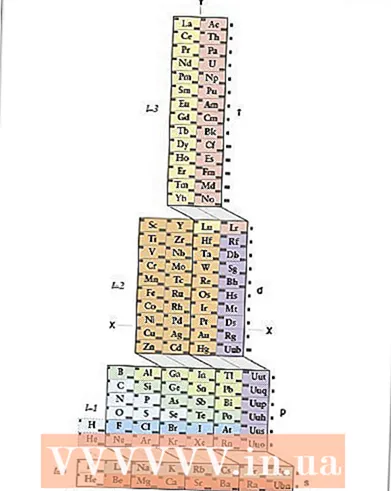
 1 ADOMAH мезгилдик таблицасын үйрөнүңүз. Электрондук конфигурацияны жазуунун бул ыкмасы жаттоону талап кылбайт, бирок кайра каралып чыккан мезгилдүү таблицаны талап кылат, анткени салттуу мезгилдик таблицада төртүнчү периоддон баштап, период номери электрондук кабыкка туура келбейт. ADOMAH мезгилдик таблицасын табыңыз - окумуштуу Валерий Циммерман тарабынан иштелип чыккан мезгилдик таблицанын өзгөчө түрү. Аны интернеттен кыска издөө менен табуу оңой.
1 ADOMAH мезгилдик таблицасын үйрөнүңүз. Электрондук конфигурацияны жазуунун бул ыкмасы жаттоону талап кылбайт, бирок кайра каралып чыккан мезгилдүү таблицаны талап кылат, анткени салттуу мезгилдик таблицада төртүнчү периоддон баштап, период номери электрондук кабыкка туура келбейт. ADOMAH мезгилдик таблицасын табыңыз - окумуштуу Валерий Циммерман тарабынан иштелип чыккан мезгилдик таблицанын өзгөчө түрү. Аны интернеттен кыска издөө менен табуу оңой. - ADOMAHдын мезгилдик таблицасында горизонталдык катарлар галогендер, асыл газдар, щелочтуу металлдар, щелочтуу жер металлдары ж. Тик мамычалар электрондук деңгээлдерге туура келет, ал эми "каскаддар" деп аталган (s, p, d жана f блокторун бириктирген диагоналдуу сызыктар) периоддорго туура келет.
- Гелий суутекке которулат, анткени бул эки элементтин тең 1с орбиталы бар. Периоддук блоктор (s, p, d жана f) оң жагында, ал эми төмөн жагында деңгээлдик сандар көрсөтүлгөн. Элементтер 1ден 120га чейинки сандыктарда көрсөтүлөт. Бул сандар нейтралдуу атомдогу электрондордун жалпы санын билдирген жалпы атомдук сандар.
- 2 ADOMAH столунда атомуңузду табыңыз. Элементтин электрондук конфигурациясын жазуу үчүн, анын белгисин ADOMAH мезгилдик таблицасынан таап, атомдук номери жогору болгон бардык элементтерди сызып салыңыз. Мисалы, эгер эрбиумдун (68) электрондук конфигурациясын жазышыңыз керек болсо, 69дан 120га чейинки бардык элементтерди сызып салыңыз.
- Столдун ылдый жагындагы 1ден 8ге чейинки сандарга көңүл буруңуз. Бул электрондук деңгээлдеги сандар, же мамычалардын номерлери. Тек гана сызылган нерселерди камтыган мамычаларды этибарга албаңыз.Эрбиум үчүн 1, 2, 3, 4, 5 жана 6 номурлуу мамычалар калат.
- 3 Орбитадагы сублевелдерди элементтериңизге эсептеңиз. Таблицанын оң жагында көрсөтүлгөн блоктун символдорун (s, p, d жана f) жана ылдый жагында көрсөтүлгөн мамычалардын сандарын карап, блоктордун ортосундагы диагоналдуу сызыктарды этибарга албаңыз жана мамычаларды төмөндөн ирети менен мамычаларга бөлүңүз. үстүнө. Дагы, бардык элементтери сызылган кутучаларга көңүл бурбаңыз. Мамычанын блокторун жазыңыз, мамычанын номеринен баштап, андан кийин блоктун символу: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (эрбиум үчүн).
- Эскертүү: Жогорудагы Er электрондук конфигурациясы электрондук деңгээл деңгээлинин өсүү тартибинде жазылган. Бул орбиталдарды толтуруу тартибинде да жазылышы мүмкүн. Бул үчүн, мамычалардын блокторун жазууда мамычаларды эмес, төмөндөн жогору каскаддарды аткарыңыз: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Электрондорду ар бир электрондук деңгээлге эсептөө. Чектелбеген элементтерди ар бир элементтен бир электрон тиркеп санап, алардын санын ар бир блок-мамычанын блок белгисинин жанына төмөнкүчө жазыңыз: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s ... Биздин мисалда, бул erbiumдун электрондук конфигурациясы.
- 5 Туура эмес электрондук конфигурацияларды карап көрүңүз. Энергиянын эң төмөнкү абалындагы атомдордун электрондук конфигурациясына байланыштуу он сегиз типтүү өзгөчө учурлар бар, алар жердин энергетикалык абалы деп да аталат. Алар электрондор ээлеген акыркы эки же үч позицияда гана жалпы эрежеге баш ийишпейт. Бул учурда, чыныгы электрондук конфигурация электрондун атомдун стандарттык конфигурациясына салыштырмалуу азыраак энергияга ээ болгон абалда экенин болжойт. Өзгөчө атомдорго төмөнкүлөр кирет:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Мо (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Па (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) жана См (..., 5f7, 6d1, 7s2).
Кеңештер
- Электрондук конфигурацияда жазылган атомдун атомдук номерин табуу үчүн, тамгаларды ээрчиген бардык сандарды (s, p, d жана f) кошуңуз. Бул нейтралдуу атомдор үчүн гана иштейт, эгер сиз ион менен иштесеңиз, анда эч нерсе иштебейт - кошумча же жоголгон электрон санын кошуу же азайтуу керек.
- Каттын артынан жазылган номер үстү жагында, текшерүүдө ката кетирбеңиз.
- "Жарым толгон туруктуулук" деген сублевод жок. Бул жөнөкөйлөтүү. "Жарым толгон" суб -деңгээлдерге тиешелүү ар кандай туруктуулук ар бир орбиталдын бир электрон менен ээлениши менен шартталган, андыктан электрондордун ортосундагы түртүлүү минимумга келет.
- Ар бир атом туруктуу абалга умтулат жана эң стабилдүү конфигурациялар s жана p (s2 жана p6) деңгээлдерин толтурат. Асыл газдар мындай конфигурацияга ээ, ошондуктан алар сейрек реакцияга кирет жана мезгилдик жадыбалдын оң жагында жайгашкан. Ошондуктан, эгерде конфигурация 3p менен бүтсө, анда ал туруктуу абалга жетүү үчүн эки электронго муктаж болот (алтысын жоготуу үчүн, анын ичинде s-деңгээлинин электрондору, көбүрөөк энергия талап кылынат, ошондуктан төртүн жоготуу оңой). Ал эми конфигурация 4d менен бүтсө, анда туруктуу абалга жетүү үчүн үч электронун жоготушу керек. Мындан тышкары, жарым-жартылай толтурулган деңгээлдер (s1, p3, d5 ..), мисалы, p4 же p2 караганда туруктуу; бирок, s2 жана p6 ого бетер бекем болот.
- Ион менен иштөөдө, бул протондордун саны электрондун санына барабар эмес экенин билдирет. Бул учурда, бир атомдун заряды химиялык белгинин жогорку оң жагында (эреже катары) көрсөтүлөт. Демек, +2 заряды бар сурьма атому 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p электрондук конфигурациясына ээ. 5p 5p болуп өзгөргөнүн эске алыңыз. Нейтралдуу атомдун конфигурациясы s жана pден башка деңгээлдерде бүткөндө этият болуңуз. Электрондорду алганыңызда, аларды валенттик орбиталдардан (s жана p орбиталдардан) гана ала аласыз.Демек, эгер конфигурация 4s 3d менен бүтсө жана атом +2 зарядга ээ болсо, анда конфигурация 4s 3d менен бүтөт. Белгилей кетсек, 3d жок с-орбиталдык электронун жоготуунун ордуна, өзгөрөт.
- Электрон "жогорку энергетикалык деңгээлге чыгууга" аргасыз болгон шарттар бар. Качан сублеведе бир электрон жарым же толук толтурулбай калганда, жакынкы s же p-деңгээлден бир электрон алып, аны электронго муктаж болгон субдеңгээлге жылдырыңыз.
- Электрондук конфигурацияны жазуунун эки варианты бар. Эрбиум үчүн жогоруда көрсөтүлгөндөй, алар энергия деңгээлинин сандарынын өсүү тартибинде же электрон орбиталдарын толтуруу тартибинде жазылышы мүмкүн.
- Сиз ошондой эле валенттүүлүк конфигурациясын жазып, элементтин электрондук конфигурациясын жаза аласыз, ал акыркы s жана p сублевеллдери. Ошентип, сурьманын валенттүүлүк конфигурациясы 5s 5p формасына ээ болот.
- Жунус окшош эмес. Бул алар менен алда канча кыйын. Эки денгээлди өткөрүп жиберип, кайдан баштаганыңызга жана электрондордун санына жараша ошол эле үлгү боюнча жүрүңүз.