Автор:
Randy Alexander
Жаратылган Күнү:
25 Апрель 2021
Жаңыртуу Күнү:
26 Июнь 2024
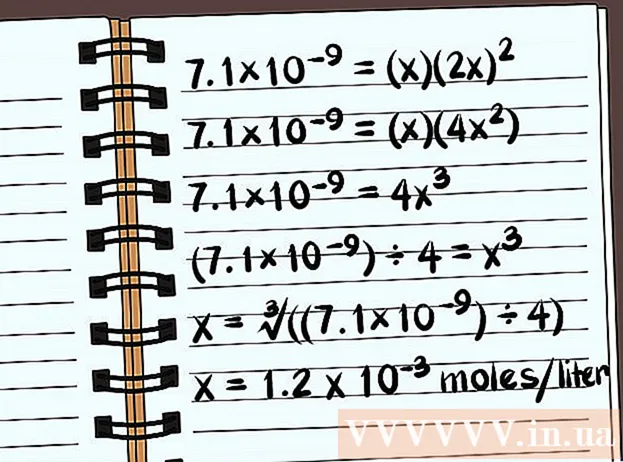
Мазмун
Химияда эригичтик катуу эритиндинин калдыгын калтырбастан, суюктукта толук эригенде, катуу кошулманын касиеттерин сүрөттөө үчүн колдонулат. Иондук бирикмелер гана (заряддалган) эрийт. Чындыгында, сууга кошулганда иондук кошулма катуу бойдон калабы же көп өлчөмдө эрийби, билиш үчүн бир нече принциптерди жаттап же адабияттарды издеш керек. Чындыгында, кандайдыр бир өзгөрүүнү байкабасаңыз дагы, белгилүү бир молекула саны эрийт, андыктан эксперименттин так болушу үчүн, ушул көлөмдөгү эригичти кантип эсептеп чыгууну билишиңиз керек.
Кадамдар
2-ыкманын 1-ыкмасы: Ыкчам эрежелерди колдонуңуз
Иондук кошулмалар жөнүндө билип алыңыз. Адатта, ар бир атомдо белгилүү бир сандагы электрон бар, бирок кээде ал электрон алат же берет. Бул процесс аны бир кылат иондор заряддалган. Терс заряды бар ион (бир электрондон ашык) оң заряддуу ионго туш болгондо (электрон жетишпейт), алар эки магниттин катоду жана аноду сыяктуу өз ара байланышат. Натыйжада иондук кошулма пайда болот.
- Иондордун терс заряды бар аниондор, иондор болсо оң зарядга ээ катион.
- Адатта атомдогу электрондордун саны протондун санына барабар, андыктан анын заряды жок.

Эригичтикти түшүнүңүз. Суу молекуласы (H2O) регулярдуу эмес түзүлүшкө ээ, андыктан магнитке окшош: бир учу оң, экинчиси терс зарядга ээ. Иондук кошулманы сууга салганда, бул суу "магниттери" айланасында чогулуп, оң жана терс иондорду бөлүп алууга аракет кылышат.- Айрым иондук кошулмалар анчалык бекем сиңбейт, алар каралат эрийт Себеби ал сууга кошулганда бөлүнүп, эрийт. Башка бирикмелер күчтүү байланыштарга ээ эрибейт анткени суу молекуласынын тартылышына карабастан иондор бири-бирине тыгыз тартылат.
- Айрым кошулмалар суу молекуласынын тартылышына барабар болгон күчкө ээ. Алар каралат бир аз эрийт анткени көпчүлүк кошулмалар бөлүнүп калат, бирок калгандары бири-бирине тартылышат.

Эритүү принцибин түшүнүү. Атомдордун өз ара аракети өтө татаал болгондуктан, кайсы туташуу мүмкүн же мүмкүн эместигин айырмалоо үчүн туюмга толугу менен таянууга болбойт. Төмөнкү тизмедеги кошулмадан биринчи ионду анын жалпы касиеттерин издеп таап, андан кийин экинчи иондун анормалдуу иштешине жол бербөө үчүн өзгөчө учурларды текшериңиз.- Мисалы, стронций хлоридин (SrCl) текшерүү үчүн2), сураныч, Sr же Cl теменку тайманбас кадамдардан изде. Cl "адатта эрийт", андыктан анын астындагы өзгөчө учурларды текшериңиз. Sr өзгөчө кырдаалдар тизмесинде жок, ошондуктан SrCl2 эрий турган болушу керек.
- Ар бир эрежеге мүнөздүү өзгөчө учурлар эреженин астында жазылган. Башка өзгөчөлүктөр бар, бирок бул кадимки химия же лабораториялык сааттарда болушу мүмкүн эмес.

Курамында Li, Na, K, Rb жана Cs сыяктуу щелочтуу металлдар болгондо эрийт. Бул металлдар IA тобу элементтери деп да белгилүү: литий, натрий, калий, рубидий жана цезий. Ушул иондордун бирин камтыган дээрлик бардык кошулмалар эрийт.- Өзгөчө: Li3PO4 эрибейт.
NO кошулмалары3, C2H3O2, ЖОК2, ClO3 жана ClO4 баары эрийт. Жогорудагы иондорго туура келген аталыштар нитрат, ацетат, нитрит, хлорат жана перхлорат. Ацетаттын көбүнчө OAc деп кыскартылаарын эске алыңыз.
- Өзгөчө: Ag (OAc) (күмүш ацетаты) жана Hg (OAc)2 (сымап ацетаты) эрибейт.
- AgNO2 жана KClO4 гана "бир аз эриген".
Cl, Br жана I кошулмалары көбүнчө эрийт. Хлорид, бромид жана иодид иондору дээрлик ар дайым галоген туздары деп аталган эрүүчү кошулмаларды түзүшөт.
- Өзгөчө: Эгерде жогоруда аталган иондордун бири Ag күмүш иондору менен айкалышса, сымап Hg2, же Pb коргошун, эрибей турган бирикмелерди пайда кылат. Ушул эле мис Cu жана thali Tl жез менен айкалышканда пайда болгон аз кездешүүчү кошулмаларга да тиешелүү.
СО камтыган бирикмелер4 адатта эрийт. Сульфат иондору көбүнчө эрүүчү кошулмаларды пайда кылат, бирок өзгөчө учурлар көп.
- Өзгөчө: Сульфат иондору төмөнкү иондор менен эрибей турган кошулманы түзүшөт: стронций Sr, барий Ba, коргошун Pb, күмүш Ag, кальций Ca, радий Ra жана Agдин күмүш атомдору2. Күмүш сульфат жана кальций сульфаты орто деңгээлде гана эрий тургандыгына көңүл бурсаңыз, кээ бирлери аларды бир аз эрийт деп эсептешет.
OH же S камтыган заттар эрибейт. Бул иондордун тиешелүү аталыштары гидроксиддер жана сульфиддер.
- Өзгөчө: Сиз щелочтуу металлдарды (I-A топтору) жана алар кандай эрий турган бирикмелерди түзүүнү жактыраарыңызды эсиңиздеби? Li, Na, K, Rb жана Cs бардыгы гидроксид же сульфид иондору менен эрий турган бирикмелерди түзөт. Мындан тышкары, гидроксиддер жердин щелочтуу металл иондору менен эрий турган туздарды пайда кылат (II-А тобу): кальций Са, стронций Sr жана барий Ba. Эскертүү: гидроксиддерден жана жердин щелочтуу металлдарынан куралган бирикмелер чындыгында бир топ молекулаларга ээ, ошондуктан алар кээде "бир аз эрийт" деп эсептелет.
СО камтыган бирикмелер3 же PO4 эрибейт. Карбонат жана фосфат иондорун акыркы жолу текшерип көрсөңүз, анда кошулмаңыз эрийби же жокпу, көрө аласыз.
- Өзгөчө: Бул иондор Li, Na, K, Rb жана Cs сыяктуу щелочдуу металлдар менен, ошондой эле NH аммоний иону менен эрий турган бирикмелерди түзөт.4.
2ден 2-ыкма: К константасынан эригичтикти эсептөөsp
Эригичтүүлүк продуктусу туруктуу К издеsp. Бул туруктуу ар бир кошулмага жараша айырмаланып турат, андыктан аны окуу китебиндеги же Интернеттеги графиктен издеш керек. Бул чоңдуктар эксперименталдык жол менен аныкталгандыктан жана графиктердин ортосунда бир кыйла айырмаланып турушу мүмкүн, эгерде бар болсо окуу китебинин графигин колдонуу жакшы. Эгерде башкача белгиленбесе, көпчүлүк участоктор сыноо температурасын 25ºС деп эсептешет.
- Мисалы, коргошун йодидин PbI формуласы менен эритип жатасыз дейли2, анын эригичтик көбөйүмдүүлүгүн туруктуу деп жаз. Эгер сиз bilbo.chm.uri.edu дарегиндеги графикке кайрылсаңыз, анда сиз 7,1 × 10 туруктуу көлөмүн колдоносуз.
Химиялык теңдеме жаз. Биринчиси, бул кошулманын эригенде иондук бөлүнүү схемасын аныктаңыз. Андан кийин K менен теңдеме жазыңызsp бир жагында жана экинчи жагында компонент иондору.
- Мисалы, PbI молекуласы2 Pb, I жана I иондоруна бөлүнөт (иондун зарядын билүү же текшерүү гана керек, анткени бардык кошулмалар ар дайым электрдик нейтралдуу болот).
- 7,1 × 10 = теңдемесин жазыңыз
- Бул теңдеме - эригичтик константасы, эригичтик графигинен 2 ионду табууга болот. 2 l- ион болгондуктан, l- квадраттык болушу керек.
Өзгөрмөлөрдү колдонуу үчүн теңдемелерди өзгөртүңүз. Молекулалар менен иондордун саны жөнүндө билген маалыматты колдонуп, теңдемени кадимки алгебралык ыкмаларды колдонуп жазыңыз. Эритилиши керек болгон кошулманын массасына барабар х коюп, х ар бир иондун санын көрсөткөн теңдемени кайра жазыңыз.
- Бул мисалда 7,1 × 10 = теңдемесин кайрадан жазышыбыз керек
- Кошулмада бир гана коргошун иону (Pb) болгондуктан, эриген молекулалардын саны эркин коргошун иондорунун санына барабар. Демек, биз аны x деп койсок болот.
- Ар бир коргошун иону үчүн эки йод иону (I) болгондуктан, биз йод атомунун санын 2хке барабар кылабыз.
- Эми теңдеме 7.1 × 10 = (x) (2x) болуп калат
Эгерде бар болсо, жалпы иондорду эске алыңыз. Эгерде кошулманы дистилденген сууда эритип жатсаңыз, анда бул кадамды өткөрүп жиберип коюңуз. Эгерде кошулма буга чейин бир же бир нече компоненттүү иондор ("жалпы иондор") бар эритмеде эритилген болсо, анда кошулманын эригичтиги кыйла төмөндөйт. Жалпы иондордун таасири дээрлик эрибеген бирикмелерге айкын көрүнөт жана бул учурда тең салмактуулуктагы иондордун көпчүлүгү мурда эритиндилерде болгон деп божомолдоого болот. Ушул маанидеги эритмени колдонуп жаткан x өзгөрмөсүнө алмаштырып, эритиндиге кирген иондордун молярдык концентрациясын (литрине моль же М) эсептөө үчүн теңдемени кайра жазыңыз.
- Мисалы, коргошун йодид кошулмасы 0.2М коргошун хлоридинин (PbCl) эритмесинде эриген болсо2), биз 7.1 × 10 = (0.2M + x) (2x) деп теңдемени кайра жазабыз. 0.2M х концентрациясы жогору болгондуктан, биз аны 7.1 × 10 = (0.2M) (2x) кылып жазсак болот.
Теңдемени чечүү. Х үчүн эриңиз, ошондо сиз кошулманын эригичтигин көрөсүз. Эригичтик константасынын аныктамасында, бир литр сууда эриген кошулманын моль саны боюнча жооп жазууңуз керек. Акыркы жоопту табуу үчүн компьютериңизди колдонушуңуз керек.
- Төмөнкү мисал - кеңири таралган иондору жок дистилденген сууда эригичтик.
- 7.1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7.1 × 10 = 4x
- (7,1 × 10) ÷ 4 = х
- x = ∛ ((7,1 × 10) ÷ 4)
- x = Литрине 1,2 х 10 моль эрийт. Бул абдан кичинекей масса, ошондуктан бул кошулма дээрлик эрибейт.
Сизге эмне керек
- Кошулманын эригичтик продуктунун туруктуу таблицасы (К.sp)
Кеңеш
- Эгерде сизде эриген бирикмелердин саны боюнча эксперименталдык маалыматтар болсо, анда ошол эле теңдемени колдонуп, К эригичтик константасы үчүн чечсеңиз болот.sp.
Эскертүү
- Бул терминдердин аныктамалары боюнча бир пикир жок, бирок химиктер көпчүлүк кошулмалар боюнча бир пикирге келишет. Эритүүчү жана эрибей турган молекулалар маанилүү курамдарды түзгөн бир катар атайын бирикмелер, алардын ар бири ушул бирикмелердин ар башкача сүрөттөлүшүнө ээ.
- Айрым эски окуу китептеринде NH каралат4OH - эрий турган кошулма. Бул туура эмес; NH иондору аз өлчөмдө аныкталган4 жана OH, бирок бул эки ион кошулмаларга бириге албайт.