Автор:
Lewis Jackson
Жаратылган Күнү:
6 Май 2021
Жаңыртуу Күнү:
1 Июль 2024
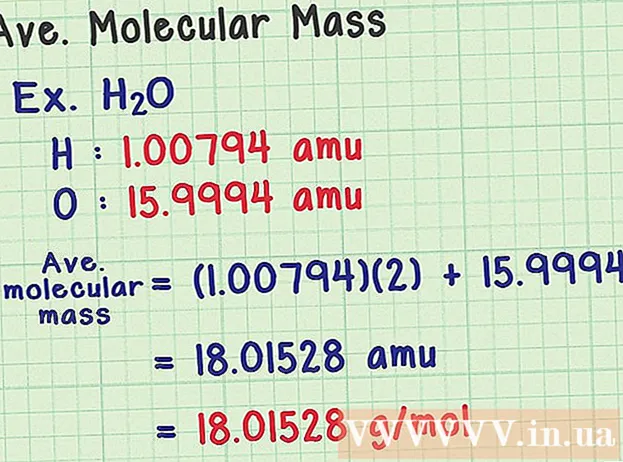
Мазмун
Орточо массалык атом атомдун массасынын түздөн-түз чарасы эмес. Тескерисинче, бул элементтин кадимки үлгүсүндөгү бир атомго орточо массасы. Эгерде сиз миллиарддаган жеке атомдордун массасын өлчөй алсаңыз, анда алардын орточо көрсөткүчүн эсептеп чыксаңыз болот. Бизде химиялык элементтин ар кандай изотоптору жөнүндө маалыматка негизделген практикалык ыкма бар.
Кадамдар
2-бөлүктүн 1-бөлүгү: Орточо массалык атомду эсептөө
Изотопторду жана массалык атомдорду түшүнүү. Жаратылышта көпчүлүк элементтер ар кандай формада же изотоптордо болот. Бир эле элементтин эки изотопунун ортосундагы айырмачылык атомдогу нейтрондордун саны гана, алардын нейтрондорунун саны массалык атомго таасир этет. Орточо массалык атомду эсептөө ушул айырмачылыктын таасирин эске алат жана ошол атомдордун ар бир атомунун орточо массасын айтып берет.
- Мисалы, күмүш элементинде (Ag) эки табигый изотоп бар: Ag-107 жана Ag-109 (же Ag жана Ag). Изотоп "массалык сан", же атомдогу протон менен нейтрон санынын суммасынын атынан аталган. Демек, Ag-109да Ag-107ге караганда эки нейтрон көбүрөөк, ошондуктан анын атому бир аз оорураак.

Ар бир изотоптун массасын табыңыз. Ар бир изотоп үчүн эки маалымат керек, аларды маалымдама китептеринен же Интернеттен издей аласыз, мисалы webelements.com. Биринчиси, ар бир изотоптун массалык атому же атомдук массасы. Нейтрону көбүрөөк изотоптордун массасы көбүрөөк.- Мисалы, күмүш изотопу Аг-107 массалык атомго ээ 106,90509 аму (куб атомунун бирдиги) Аг-109 изотопу массасы менен бир аз оорураак 108,90470.
- Аягындагы ондуктардын жупу документтерде бир аз башкача болушу мүмкүн. Массанын артынан кашаанын ичине эч кандай сандарды жазбаңыз.

Ар бир изотоп үчүн табигый жашоонун деңгээлин жазыңыз. Бул катыш элементтин жалпы атомдорунун пайыздык үлүшү менен изотоптун кеңири жайылышын көрсөтөт. Бул маалыматты ошол эле документтен, анын үстүндө куб атому менен таба аласыз. Бардык изотоптордун табигый жашоосу 100% түзүшү керек (бирок тегеректөө катасынан улам бир аз айырмаланышы мүмкүн).- Аг-107 изотопунун катышы 51,86% түзөт. Аг-109 изотопу 48,14% ченде аз кездешет. Демек, кадимки күмүш үлгүсүндө 51,86% Аг-107 жана 48,14% Аг-109 бар.
- Мындай жашоо деңгээлине ээ болбогон ар кандай изотоптор эске алынбайт. Бул изотоптор табигый түрдө жер бетинде жок.

Изотоптун пайызын ондук санга айландыруу. Бул катышты 100гө бөлсөк, ондуктун маанисине ээ болот.- Жогорудагы күмүш үлгүсүндө изотоптордун катышы 51,86 / 100 = 0,5186 жана 48,14 / 100 = 0,4814.
Орточо кубдуу атомду табыңыз. Элементтин орточо массалык атому бар н изотоптору барабар (Атомдук блокИзотоп 1 * катышИзотоп 1) + (атомдук массаИзотоп 2 * катышИзотоп 2) + ... + (куб атомизотоптор н * катышизотоптор н. Бул "орточо массанын" мисалы, демек изотоптун жашоо деңгээли канчалык чоң болсо, анын натыйжага таасири ошончолук жогору болот. Бул формуланы күмүшкө кантип колдонсо болот:
- Орточо массалык атомAg = (куб атомAg-107 * катышAg-107) + (атомдук массаAg-109 * катышAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107.8677 аму. - Жыйынтыгын текшерүү үчүн мезгилдик системадан ошол элементти табыңыз. Орточо куб атому ар дайым элементтин химиялык белгисинин астында жазылат.
- Орточо массалык атомAg = (куб атомAg-107 * катышAg-107) + (атомдук массаAg-109 * катышAg-109)
2-бөлүк 2: Натыйжаларды колдонуу
Массаны атомдук санга айландыруу. Орточо массалык атом ошол элементтин типтүү үлгүсүндөгү масса менен атомдордун санынын ортосундагы байланышты көрсөтөт. Бул химиялык лабораторияларда абдан пайдалуу, анткени атомдорду так саноо дээрлик мүмкүн эмес, бирок массаларды аныктоо оңой. Мисалы, сиз күмүштүн үлгүсүн өлчөп, ар бир 107,8677 аму үчүн бирден күмүш атому бар экендигин билсеңиз болот.
Молярдык массага айландыруу. Атомдук масса бирдиги өтө кичинекей, ошондуктан химиктер көбүнчө масса үчүн грамм бирдигин колдонушат. Бактыга жараша, бизде бул түшүнүктөрдүн аныктамалары бар, ошондуктан трансформация оңой болушу керек. Жөн гана орточо массалык атомду 1 г / моль (молярдык масса туруктуу) көбөйтүп, натыйжада г / моль болот. Мисалы, 107,8677 грамм күмүштө бир мол күмүш атому бар.
Орточо молекулалык массаны тап. Молекула атомдордун жыйындысы болгондуктан, бардык атомдордун массасын кошуп, молекулалык массаны табууга болот. Эгерде сиз орточо массалык атомду (белгилүү бир изотоптун ордуна) колдоно турган болсоңуз, анда табияттагы үлгүнүн орточо молекулалык массасы пайда болот. Бул жерде бир мисал:
- Суу молекуласында H химиялык формуласы бар2О эки суутек атомун (H) жана бир кычкылтек (O) атомун камтыйт.
- Суутектин орточо массалык атому 100794 аму. Кычкылтектин орточо атомдук массасы 159994 аму.
- Демек, Н орточо молекулалык массасы2O (1,00794) (2) + 15,9994 = 18,01528 аму барабар, ал 18 01528 г / мольга барабар.
Кеңеш
- Салыштырмалуу атомдук масса түшүнүгү кээде орточо массалык атом менен синоним катары колдонулат. Бир аз айырмачылык бар, анткени атомдук масса салыштырмалуу ун бирдиги; бул көмүртек-12 атомуна салыштырмалуу массаны өлчөө. Орточо кубдук атомун эсептөөдө атомдук масса бирдигин колдонгончо, бул эки чоңдук бирдей.
- Куб атомунан кийинки кашаадагы сан бизге катаны билдирет. Мисалы, массалык атом 1.0173 (4) элементтин кадимки атомунун массалык диапазону болжол менен 1.0173 ± 0.0004 экендигин билдирет. Бул номер суралбаса, аны алуунун кажети жок.
- Периоддук таблицада төмөнкү элементтин орточо куб атому ага чейинки атомдукунан чоңураак, өзгөчө учурларды эске албаганда. Натыйжаларыңызды текшерүүнүн тез ыкмасы.
- 1 атомдук масса бирдиги - көмүртек-12 атомунун 1/12 массасы.
- Изотоптордун аман калуу көрсөткүчтөрү жер бетиндеги табигый мүнөздөгү үлгүлөргө ылайык эсептелет. Метеориттер сыяктуу табигый эмес заттар же лабораторияда өндүрүлгөн изотоптордун катышы ар башка болушу мүмкүн, ошондуктан орточо массалык атом да ар башка болот.
Эскертүү
- Массалык атомдор ар дайым атомдук масса бирдиктеринде (аму же u) жазылат, кээде дальтон (Da) деп аталат. Бул сандан кийин эч качан башка бирдиктүү массанын бирдигин (мисалы, килограммды) өзгөртпөстөн жазбаңыз.
Сизге эмне керек
- Карандаш
- Кагаз
- Ноутбук
- Табиятта изотоптордун жашоо деңгээли жөнүндө маалыматтар.
- Изотоптор үчүн массалык атомдук бирдиктин маалыматтары.