Автор:
Randy Alexander
Жаратылган Күнү:
1 Апрель 2021
Жаңыртуу Күнү:
1 Июль 2024
Мазмун
Химияда, валенттүүлүк электрондору бул элементтин электрондук катмарынын эң сырткы катмарында жайгашкан электрондор. Элементтин валенттүүлүк электрондорунун санын аныктоо химияда маанилүү көндүм болуп саналат, анткени бул маалымат элементтер түзө турган байланыш түрлөрүн аныктоого жардам берет. Валенттик электрондордун санын аныктоону химиялык элементтердин мезгилдик системасы менен оңой жүргүзсө болот.
Кадамдар
2-бөлүктүн 1-бөлүгү: Периоддук системаны колдонуп, валенттик электрондордун санын табыңыз
Өткөөл эмес металл менен
Бирөөсүн даярдаңыз мезгилдик таблица химиялык элементтер. Элементтердин мезгилдик системасы (кыскасы, мезгилдик система) - бул белгилүү элементтердин тизмесин камтыган, ошондой эле кээ бир маанилүү маалыматтарды камтыган түстүү коддуу көп уячалуу таблица. ошол элементтер. Мезгилдик таблицада бар маалыматтардын негизинде биз изилдеп жаткан элементтин валенттик электрондорунун санын аныктай алабыз. Адатта, мезгилдик таблица окуу куралына тиркелет. Ушул интерактивдүү мезгилдик таблицага да кайрылсаңыз болот.

Мезгилдик таблицада ар бир тилкени 1ден 18ге чейин номерлеңиз. Адатта, мезгилдик таблицада бир тилкедеги бардык элементтер бирдей валенттик электронуна ээ болот. Эгер мезгилдик таблицаңызда дагы эле тилкелер номерлене элек болсо, анда тигинен солго оңго чейин тигинен 1ден 18ге чейин сан коюп, өзүңүз жасаңыз. Илимий түрдө мезгилдик системанын ар бир тилкеси бир деп аталат "топ".- Мисалы, кол коюлбаган мезгилдик система үчүн биз Водород (Н) элементинин үстүндө 1, Бери (Ве) элементинин үстүндө 2 санын алып, Гелийден (He ).

Каралып жаткан элементтин ордун аныктаңыз. Бул кадамда мезгил-мезгили менен табылган элементтин ордун аныктаңыз. Элементтин ордун анын химиялык белгисине (ар бир уячадагы тамга), атомдук номерге (ар бир уячанын сол жагындагы жогорку бурчтагы санга) же маалыматка таянып таба аласыз. билдирүүлөр мезгилдик таблицада бар.- Мисалы, элементтин валенттик электрондорунун санын табышыбыз керек Көмүртек (C). Элементтин атомдук номери 6. Көмүртек 14-топтун жогорку бөлүгүндө, кийинки кадамда бул элементтин валенттүүлүк электрондорунун санын аныктайбыз.
- Бул бөлүмдө биз Өткөөл металлдарды, башкача айтканда, 3-12 топтордун аралыгындагы элементтерди эске албайбыз, бул өткөөл металлдар калгандарынан бир аз айырмаланат, андыктан кадамдар Бул бөлүмдө келтирилген көрсөтмөлөр мындай металлдарга жайылтылбайт. Ушул топтордун элементтерин макалада кийинчерээк карайбыз.

Валенттүүлүк электрондорунун санын аныктоо үчүн топтун номерин пайдаланыңыз. Өткөөл эмес металлдын топтук номерин ошол элементтин атомундагы валенттүүлүк электрондорунун санын эсептөө үчүн колдонсо болот. "Топтун номер бирдиги" - бул топтун элементтеринин атомдорунда болгон валенттик электрондорунун саны. Башкача айтканда:- 1-топ: 1 валенттик электрон
- 2-топ: 2 валенттик электрондор
- 13-топ: 3 валенттик электрондор
- 14-топ: 4 валенттик электрондор
- 15-топ: 5 валенттик электрондор
- 16-топ: 6 валенттик электрондор
- 17-топ: 7 валенттик электрондор
- 18-топ: 8 валенттик электрондор (2 валенттик электрондору бар гелийден тышкары)
- Көмүртек мисалында, көмүртек 14-топто болгондуктан, көмүртек атому бар деп айтсак болот төрт валенттик электрон.
Өткөөл металл менен
3-топтон 12-топко чейинки элементти аныктаңыз. Жогоруда айтылгандай, 3төн 12ге чейинки топтордогу элементтер "өткөөл металлдар" деп аталып, валенттүүлүк электрондору жөнүндө сөз болгондо, алардын калгандарынан айырмаланган өзгөчөлүктөрү бар. Бул бөлүмдө эмне үчүн валенттик электрондорду өткөөл металдардын атомдоруна ыйгаруу мүмкүн эместигин билебиз.
- Бул бөлүмдө, мисалы, атомдук номери 73 болгон Тантан (Ta) элементин алабыз. Кийинки кадамдар элементтин валенттик электрондорунун санын аныктоого жардам берет.
- Белгилей кетчү нерсе, үч үй-бүлөлүк лантанын жана актинийдин элементтери ("сейрек кездешүүчү жер металлдары" деп да аталат) өткөөл металдардын тобуна кирет - элементтердин бул эки тобу, адатта, мезгилдик таблицанын астында келтирилген. лантан жана актини менен баш.
Өткөөл металлдардагы валенттүүлүк электрондору "кадимки" валенттик электрондорго окшош эмес. Өтмө металлдар эмне үчүн мезгилдүү системанын башка элементтери сыяктуу эле "иштебей" тургандыгын түшүнүү үчүн, төмөндө түшүндүрүлгөндөй, атомдордо электрондор кандайча иштээрин бир аз билишибиз керек. , же бул кадамды өткөрүп жиберсе болот.
- Электрондорду атомго киргизгенде, алар ар башка "орбитальдарга" жайгашат - башкача айтканда, ядронун айланасындагы ар башка аймактарга. Кыскача айтканда, валенттик электрондор - бул эң сырткы катмар орбитасында жайгашкан электрондор - башкача айтканда, атомго акыркы кошулган электрондор.
- Орбитаны майда-чүйдөсүнө чейин түшүндүрүп берүү, бир аз татаалдаштырылган, себеби электрондук класска электрон кошулганда г. Өткөөл металлдын атомдук кабыгынын (төмөндө караңыз), бул электрондордун биринчиси кадимки валенттүүлүк электрондору сыяктуу жүрөт, бирок андан кийин алардын касиеттери эки эсе өзгөрүшү мүмкүн башка орбитальдардан чыккан электрондор валенттик электрондордун ролун аткара алса. Башкача айтканда, атом учурга жараша бир нече валенттүүлүк электронуна ээ болушу мүмкүн.
- Бул тууралуу көбүрөөк маалыматты Clackamas Community College валенттик электрондук сайттан алсаңыз болот.
Топтун номерине таянып, валенттик электрондордун санын аныктаңыз. Өткөөл эмес металлдар үчүн жогоруда белгиленгендей, мезгилдик системада топтун номери валенттүүлүк электрондорунун санын аныктоого жардам берет. Бирок, өткөөл металлдын валенттүүлүк электрондорунун так санын аныктоочу формула жок - бул учурда, элементтин валенттүүлүк электрондорунун саны белгиленген мааниде эмес, нерселердин саны. өз алдынча топтор валенттүүлүк электрондорунун салыштырмалуу санын гана айта алышат. Чоо-жайы:
- 3-топ: 3 валенттик электрондор
- 4: 2 ден 4 валенттик электрондорго чейинки топтор
- 5-топ: 2ден 5ке чейин валенттик электрондор
- 6-топ: 2ден 6га чейин валенттик электрондор
- 7-топтор: 2ден 7ге чейин валенттик электрондор
- 8: 2 ден 3 валенттик электрондорго чейинки топтор
- 9-топтор: 2ден 3кө чейин валенттик электрондор
- 10: 2 ден 3 валенттик электрондорго чейинки топтор
- 11: 1ден 2ге чейинки валенттик электрондор
- 12-топ: 2 валенттик электрондор
- 5-топтогу Танта (Та) элементинен мисал келтирсек, бул элемент бар деп айтсак болот 2ден 5ке чейин валенттик электрондор, жагдайга жараша.
2ден 2-бөлүк: Электрондук конфигурациянын негизинде валенттик электрондордун санын табыңыз
Электрондук конфигурацияны кантип окууну үйрөнүңүз. Элементтин электрондук конфигурациясынын негизинде, ошол элементтин валенттик электрондорунун санын да аныктай алабыз. Электрондук конфигурация татаал көрүнөт, бирок мыйзамды түшүнгөндөн кийин, элементтин орбиталын тамгалар жана сандар түрүндө кандайча чагылдыруу кыйын эмес.
- Натрийдин (Na) электрондук конфигурациясынын мисалын карап көрөлү:
- 1s2s2p3s
- Эгерде сиз көңүл бурсаңыз, анда электрондук конфигурация кайталанган бир сап гана экендигин көрө аласыз:
- (сан) (сөз) (сан) (сөз) ...
- ... жана башка. Group (сан) (сөз) биринчиси - орбиталдын аты жана ал орбиталдагы электрондордун санын билдирет.
- Демек, биздин учурда, натрий бар деп айта алабыз 1s орбитасындагы 2 электрон, 2s орбиталык 2 электрон, 2р орбиталык 6 электрон жана 3 3 с орбиталык 1 электрон. Жалпысынан 11 электрон - натрийдин атомдук саны дагы 11.
- Натрийдин (Na) электрондук конфигурациясынын мисалын карап көрөлү:
Сиз карап жаткан элементтин электрондук конфигурациясын табыңыз. Элементтин электрондук конфигурациясын билгенден кийин, ал элементтин электрондук конфигурациясын табуу кыйын эмес (өткөөл металдардан башка учурларда). Эгерде сизде электрондук конфигурация бар болсо, анда сиз чечишиңиз керек болгон суроолорго жооп берсеңиз болот. Электрондук конфигурацияны табыш керек болсо, төмөнкү кадамдарды аткарыңыз:
- Ununocti (Uuo) элементинин толук электрондук конфигурациясы, атомдук номер 118:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Ушундай толук электрондук конфигурацияга ээ болгондон кийин, башка элементтин электрондук конфигурациясын табыш үчүн, биринчи орбитадан баштап, электрондордун саны толгончо, орбитальдарды электрондор менен толтуруу керек. Бул татаал угулат, бирок аны аткарууга келгенде салыштырмалуу оңой. Мисалы, хлордун (Cl) электрондук конфигурациясын, 17 элементин, башкача айтканда, бул элементтин атомунда 17 электрон бар экендигин жазууну кааласак, анда төмөнкүнү толтурмакпыз:
- 1s2s2p3s3p
- Электрондордун конфигурациясындагы электрондордун жалпы саны туура 17ге туура келгенин эске алыңыз: 2 + 2 + 6 + 2 + 5 = 17. Акыркы орбиталдагы санды гана өзгөртүү керек - калганы ошол бойдон кала берет, анткени жакынкы орбитал толгон. электрон.
- Элементтин электрондук конфигурациясын жазуу жөнүндө көбүрөөк билүү.
- Ununocti (Uuo) элементинин толук электрондук конфигурациясы, атомдук номер 118:

Сегизинчи эрежеге ылайык, орбитальдарга электрондорду дайындаңыз. Электрондорду атомго кошкондо, жогоруда айтылган тартипте орбиталга бөлүштүрүлөт - биринчи эки электрон 1с орбиталына, кийинки эки электрон 2с орбиталга, кийинки алты электрон орбиталга жайгаштырылат 2p, электрон тиешелүү орбиталга жайгаштырылганга чейин жаса. Өткөөл эмес элементтердин атомдорун карап чыкканда, бул орбиталдар ядронун айланасында «катмарларды» пайда кылат деп айта алабыз, анда төмөнкү катмар өзөктөн андан мурункусуна караганда алысыраак болот. Эки электронду гана камтый ала турган биринчи орбиталык катмардан тышкары, кийинки бардык орбиталык катмарлар сегизге чейин электронду батыра алышат (өткөөл металлдарды кошпогондо). Бул эреже деп аталат Сегиз эсе эреже.- Мисалы, Bo (B) элементин карап көрөлү. Бул элементтин атомдук номери 5, андыктан бул элементтин электрондук конфигурациясы төмөнкүдөй: 1s2s2p. Биринчи орбиталык кабыкта 2 гана электрон болгондуктан, Бо эки орбиталык катмарга ээ экендигин аныктоого болот: биринчиси 1s орбитасында 2 электрондон турган, экинчиси 2s жана 2p орбитальдарында тараган үч электрон менен. .
- Дагы бир мисал, хлорго окшош элементтин үч катмары болот: 1s орбиталындагы эки электрон катмары, 2s орбиталындагы эки электрон катмары жана 2p орбиталындагы алты электрон жана 3 орбиталдагы эки электрондун сырткы катмары. жана 3p орбиталык беш электрон.

Эң сырткы катмардагы электрондордун санын табыңыз. Электрондордун конфигурациясы аныкталгандан кийин, биз ал элементтин катмарларын билебиз, валенттүүлүктүн электрондорунун санын табуу атом электрондор кабыгынын эң сырткы катмарындагы электрондордун санын аныктоо аркылуу болот. Эгерде эң сырткы катмар толук болсо (б.а. жалпысынан сегиз электрон бар болсо, же биринчи катмар 2 электрон болсо), анда ал элемент инерттүү элемент деп аталат жана химиялык реакцияларга дээрлик катышпайт. Бирок, бул эреже өткөөл металдарга жайылтылбайт.- Мисалы, Бо, экинчи катмарда үч электрон болгондуктан, анын эң сырткы катмары болгондуктан, Бо элементин ээ деп айта алабыз. Ата валенттүүлүк электрондору

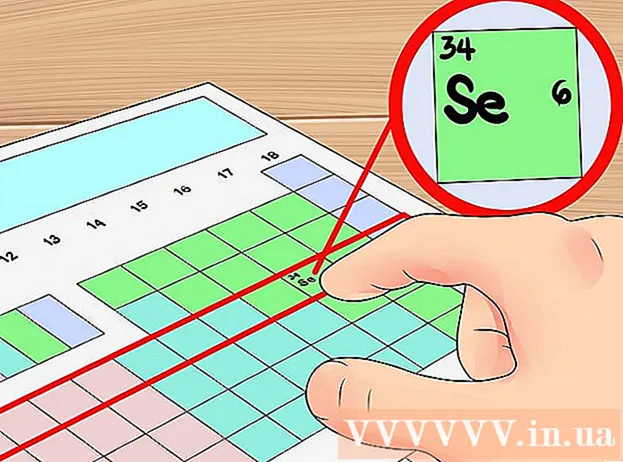
Периодикалык таблицада катар номерин орбиталык катмарлардын санын аныктоонун кыскартылган жолу катары колдонуңуз. Периоддук таблицада горизонталдык катар деп аталат "цикл" элементтердин Биринчи катардан баштап, ар бир цикл ошол эле мезгилдеги элементтердин 'электрон катмарларынын санына' туура келет. Демек, мезгилдин жардамы менен элементтин валенттик электрондорунун санын тез арада аныктай аласыз - электрондордун санын ошол мезгилдин биринчи элементинен баштап солдон оңго карай иретинде эсептесеңиз болот. Дагы бир жолу белгилей кетүүчү нерсе, бул өткөөл металлдарга карата колдонулбайт.- Мисалы, селен 4-циклге таандык болгондуктан, элементтин атомдук кабыгында төрт электрондук катмар бар экендигин аныктоого болот. Солдон оңго карай, бул 4-циклдеги алтынчы элемент (өткөөл металлды эсепке албаганда), селендин төртүнчү кабыгында алты электрон бар, башкача айтканда, бул элемент алты валенттик электрон.
Кеңеш
- Эскертүү, электрондук конфигурацияны конфигурациянын жогору жагындагы орбиталдардын ордуна сейрек кездешүүчү газдарды (18-топтун элементтери) колдонуу менен кыскача жазууга болот. Мисалы, натрийдин электрондук конфигурациясын 3s1 деп жазса болот, башкача айтканда, натрийдин электрондук конфигурациясы Неондукуна окшош, бирок 3s орбитасында кошумча электрон бар.
- Өтмө металлдардын толук эмес валенттүүлүк подкласстары болушу мүмкүн. Өткөөл металлдын валенттик санын так аныктоо үчүн, ушул макалада каралбаган татаал кванттык принциптерди колдонуу керек.
- Химиялык элементтердин мезгилдик системасы ар кайсы өлкөлөрдө ар кандай болушу мүмкүн экендигин дагы белгилей кетүү керек. Ошентип, башаламандыкты болтурбоо үчүн жашаган мезгилдүү жалпы таблицаны колдонуп жатканыңызды текшерип коюңуз.
Сизге эмне керек
- Химиялык элементтердин мезгилдик системасы
- Карандаш
- Кагаз