Автор:
Lewis Jackson
Жаратылган Күнү:
12 Май 2021
Жаңыртуу Күнү:
1 Июль 2024
Мазмун
Электрондук конфигурация атому - бул электрондук орбиталдарды чагылдырган сандар тизмеги. Electron Obitans - бул атомдордун ядросун курчаган ар кандай формадагы мейкиндик аймактары, аларда электрондор иреттүү тартипте жайгашат. Электрондук конфигурация аркылуу атомдо канча электрон орбиталы бар экендигин жана ар бир орбитада электрондордун санын тез аныктай аласыз. Электрондук конфигурациянын негизги принциптерин түшүнгөндөн кийин, өзүңүздүн электрондук конфигурацияңызды жазып, химиялык тесттерди ишенимдүү жасай аласыз.
Кадамдар
2-ыкманын 1-ыкмасы: Химиялык мезгилдик системаны колдонуп, электрондордун санын аныктаңыз
Атомдун атомдук номерин тап. Ар бир атомдун өзүнө тиешелүү белгилүү бир саны электрон бар. Периоддук таблицада элементти табыңыз. Атомдук сан 1ден (суутек үчүн) башталып, андан кийинки ар бир атом үчүн 1ге көбөйтүлүүчү оң бүтүн сан. Атомдук сан - бул атомдун протонунун саны, демек, ал негизги абалда атомдун электрондорунун саны.
- Атомдун зарядын аныкта. Электрдик нейтралдуу атом мезгилдүү системада көрсөтүлгөндөй электрондордун туура санына ээ. Бирок заряды бар атом, заряд чоңдугуна жараша аздыр-көптүр электрондорго ээ болот. Эгерде сиз заряддуу атомдор менен иштеп жаткан болсоңуз, анда ага ылайыктуу электрондордун санын кошуңуз же алып салыңыз: ар бир терс зарядга бирден электрон кошуп, ар бир оң зарядга бирден электрон чыгарыңыз.
- Мисалы, +1 заряды бар натрий атомунун базалык атом номери 11ден бир электрон алынып салынат, демек, натрий атому жалпысынан 10 электрон болот.
- Негизги орбиталык тизмени жаттап алыңыз. Атом электрон алганда, бул электрондор белгилүү бир тартипте орбиталга жайгашат. Электрондор орбитальдарды толтурганда, ар бир орбитальдагы электрондордун саны жуп болот. Бизде төмөнкүдөй орбитальдар бар:
- Обитан с (ар кандай санда электрондук конфигурациянын артында "s" бар) бир гана орбиталы бар жана ээрчүү Паулиден башкасыАр бир орбиталда эң көп дегенде 2 гана электрон бар, ошондуктан ар бир s орбиталда 2 гана электрон болушу мүмкүн.
- Обитан р 3 орбитальга ээ, ошондуктан ал 6 электронду камтый алат.
- Обитан д 5 орбитальга ээ, ошондуктан ал 10 электронду камтый алат.
- Обитан ф 7 орбитальга ээ, ошондуктан 14 электронду камтыйт.Төмөнкү уккулуктуу сүйлөм боюнча орбиталдардын иретин жаттаңыз:
Sбоюнча Pагрессивдүү Д.ух FБолуптур Gукпаган HОй ÍKМен келем.
Көптөгөн электрондору бар атомдор үчүн к-тамгасынан кийин орбитальдар алфавит боюнча жазылып, колдонулган белгилер калтырып кетет.
- Электрондордун конфигурациясын түшүнүү. Электрондордун конфигурациясы атомдогу электрондордун санын, ошондой эле ар бир орбиталдагы электрондордун санын так көрсөтүү үчүн жазылган. Ар бир орбитал белгилүү бир тартипте жазылат, орбиталдагы электрондордун саны орбиталык аталыштын укугунун жогору жагында жазылган. Акырында, электрондук конфигурация - бул орбиталдардын аталыштарынан жана алардын оң жагында жогоруда жазылган электрондордун санынан турган ырааттуулук.
- Төмөнкү мисал жөнөкөй электрондук конфигурация: 1s 2s 2p. Бул конфигурация 1s орбитасында эки электрон, 2s орбиталында эки электрон жана 2p орбиталында алты электрон бар экендигин көрсөтөт. 2 + 2 + 6 = 10 электрон (бардыгы болуп). Бул электрондук конфигурация электрдик нейтралдуу неон атомуна арналган (неондун атомдук номери 10).
- Орбитальдардын кезегин жаттап алыңыз. Орбитальдар электрондук класска ылайык номерленгенин, бирок энергетикалык иреттелгенин эске алыңыз. Мисалы, 4s каныккан же каныкпаган 3d орбиталга караганда төмөн энергия (же узак мөөнөттүү) менен каныккан, ошондуктан биринчи 4s подкласс жазылат. Орбиталдардын ирээтин билгенден кийин, электрондорду атомдогу электрондордун санына жараша тизип койсо болот. Электрондорду орбиталга жайгаштыруу тартиби төмөнкүдөй: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- Ар бир электронго толгон орбиталы бар атомдун электрондук конфигурациясы төмөнкүчө жазылат: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Эгерде бардык катмарлар толтурулса, анда жогоруда аталган электрондук конфигурация Ог (Оганессон), 118 болуп саналат, бул мезгилдүү системанын эң жогорку номерлүү атому - учурда белгилүү болгон бардык электрондук катмарларды камтыйт электрдик нейтралдуу атом менен
- Атомдогу электрондордун санына жараша электрондорду орбитальдарга бөлүп алыңыз. Мисалы, электрдик нейтралдуу кальций атомунун электрондук конфигурациясын жазгыңыз келсе, биринчиден, мезгилдик системада анын атомдук номерин табуу керек. Кальцийдин атомдук саны 20, андыктан 20 электрону бар атомдун конфигурациясын жогорудагы тартипте жазабыз.
- Электрондорду 20 электронго жеткенге чейин орбитальдарга жогорудагы тартипте коюңуз. Обитан 1с эки электрон алат, 2с экиге, 2п алтыга, 3с экиге, 3р алтыга, ал эми 4с экиге ээ болот (2 + 2 + 6 +2 +6 + 2 = 20). Демек, кальцийдин электрондук конфигурациясы: 1s 2s 2p 3s 3p 4s.
- Эскертүү: Электрондук катмар көбөйгөн сайын энергия деңгээли өзгөрөт. Мисалы, 4-энергетикалык деңгээлге жазганда, алгач 4s подклассы жазылат, кийинчерээк 3d чейин. Төртүнчү энергетикалык деңгээлди жазгандан кийин, бешинчи деңгээлге өтүп, катмарлануу тартибин кайрадан баштайсыз. Бул 3-энергетикалык деңгээлден кийин гана болот.
- Көрүнүктүү жарлык катары мезгилдик таблицаны колдонуңуз. Мезгил-мезгили менен таблицанын формасы электрон конфигурациясындагы орбиталдардын тартибине дал келгенин байкагандырсыз. Мисалы, экинчи колоннадагы атомдор солдон оңго ар дайым "s" менен аякташса, ортоңку бөлүктүн эң оң жагындагы атомдор ар дайым "d" менен аякташат ж.б. Курулмаларды жазуу үчүн мезгилдик таблицаны колдонуңуз. фигура - электрондордун орбитальдарга жайгашуу тартиби периоддук таблицада көрсөтүлгөн позицияларга дал келет. Төмөндө караңыз:
- Эң сол жактагы эки тилке - бул электрондук конфигурациясы s орбиталында бүтөт, периоддук системанын оң бөлүгү - p орбиталы менен аяктаган, электрондук конфигурациясы бар атомдор, ортоңку бөлүгү - s орбитасында бүтөт. d, жана төмөндө f орбитасында аяктаган атомдор жайгашкан.
- Мисалы, хлор элементинин электрондук конфигурациясын жазууда төмөнкү аргументти келтир: Бул атом периоддук системанын үчүнчү катарында (же "периодунда") турат. Ошондой эле периоддук таблицада орбиталык блоктун бешинчи тилкесинде жайгашкан. Ошентип, электрон конфигурациясы бүтөт ... 3б.
- Абайлагыла! Периоддук системанын d жана f орбиталык класстары алардын мезгилинен айырмаланган энергия деңгээлдерине туура келет. Мисалы, d орбиталык блоктун биринчи сабы 4-периоддо болсо дагы, 3d орбиталга туура келет, ал эми f орбиталдын биринчи катарында 6 периоддо болсо дагы, 4f орбиталга туура келет.
- Кыйроочу электрон конфигурацияларын жазууну үйрөнүңүз. Периоддук системанын оң четиндеги атомдор деп аталат сейрек кездешүүчү газ. Бул элементтер химиялык жактан өтө инерттүү. Узун электрондук конфигурацияны кыскартуу үчүн, квадраттык кашаага сейрек кездешүүчү газдын атомуна караганда азыраак электрону бар химиялык белгини жазыңыз, андан кийин кийинки орбиталдардын электрондук конфигурацияларын жазууну улантыңыз. . Төмөндө караңыз:
- Бул түшүнүктү түшүнүү үчүн электрондук конфигурациянын мисалын жазыңыз. Биз сейрек кездешүүчү газ конфигурациясы аркылуу цинкти азайтуу үчүн электрондук конфигурацияны (атомдук номер 30) жазышыбыз керек дейли. Цинктин толук электрондук конфигурациясы: 1s 2s 2p 3s 3p 4s 3d. Бирок, 1s 2s 2p 3s 3p сейрек кездешүүчү агоникалык газдын конфигурациясы экендигин эске алыңыз. Жөн гана цинктин электрондук белгилеринин бул бөлүгүн төрт бурчтуу кашаадагы агондук химиялык белгиге алмаштырыңыз ().
- Демек, цинктин электрондук конфигурациясы тыгыз 4s 3d.
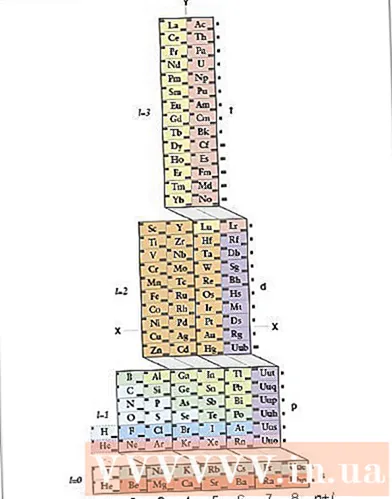
2ден 2-ыкма: ADOMAH мезгилдик системасын колдонуу

ADOMAH мезгилдик системасын изилдеңиз. Электрондук конфигурацияны жазуунун мындай ыкмасы жаттоону талап кылбайт. Бирок, бул метод үчүн кайрадан уюштурулган мезгилдик система керек, анткени кадимки мезгилдик системада, төртүнчү катардан баштап, циклдердин саны электрондук катмарга дал келбейт. Илимпоз Валерий Циммерман тарабынан иштелип чыккан атайын химиялык мезгилдик таблицаны, ADOMAH мезгилдик системасын табыңыз. Бул мезгилдик таблицаны интернеттен таба аласыз.- ADOMAH мезгилдик системасында горизонталдык катарлар галогендер, инерттик газдар, щелочтуу металлдар, жердин щелочтуу металлдары жана башкалар сыяктуу элементтердин топтору болуп саналат. Тик мамычалар электрондук катмарга туура келет жана аларды "тепкичтер" (диагоналдык байланыштар) деп аташат. s, p, d жана f) блоктору мезгилге туура келет.
- Гелий суутектин жанына жайгаштырылган, анткени экөө тең өзгөчө 1s орбитасына ээ. Периоддук блоктор (s, p, d жана f) оң жагында, ал эми электрондук катмарлардын саны түбүндө көрсөтүлгөн. Элементтин аттары 1ден 120га чейин коюлган төрт бурчтукка жазылат. Бул сандар кадимки атомдук сандар, электрдик нейтралдуу атомдогу электрондордун жалпы санын билдирет.
- ADOMAH мезгилдик системасындагы элементти тап. Элементтин электрондук конфигурациясын жазуу үчүн, анын белгисин ADOMAH мезгилдик системасынан таап, атомдук номерлери жогору болгон элементтердин бардыгын сызып сал. Мисалы, eribi (68) электрондук конфигурациясын жазгыңыз келсе, 69дан 120га чейинки элементтерди сызып салыңыз.
- Мезгилдик таблицанын негизиндеги 1ден 8ге чейинки сандарды белгилеңиз. Бул электрондук катмарлардын же мамычалардын саны. Чектелген гана элементтер камтылган тилкелерге көңүл бурбаңыз.Eribi үчүн калган тилкелер 1, 2, 3, 4, 5 жана 6.
- Конфигурацияны жазуу үчүн атомдун орду боюнча орбиталдардын санын эсептеңиз. Периоддук таблицанын оң жагында көрсөтүлгөн блок белгилерин карап (s, p, d жана f) жана блоктордун ортосундагы диагоналдык сызыктарга карабастан, таблицанын түбүндө көрсөтүлгөн тилкенин санын карап, мамычаларды колонна-блокторго бөлүп, жазыңыз алар ылдыйдан жогору карай тартипте. Чектелген гана элементтер камтылган мамыча блокторуна көңүл бурбаңыз. Мамыча блокторун мамычанын номеринен баштап блоктун символу менен жазып алыңыз, мындайча: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (eribi учурда).
- Эскертүү: Er үчүн жогоруда келтирилген электрондук конфигурация, электрондук катмарлардын санынын өсүү тартибинде жазылган. Бул конфигурацияны электрондорду орбитальдарга жайгаштыруу тартибинде дагы жазса болот. Блок-блокторду жазууда тилкелердин ордуна жогорудан ылдый карай кадамдарды аткарыңыз: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Орбиталдагы электрондордун санын эсептөө. Ар бир мамыча-блокто сызылбаган электрондордун санын эсептеп, бир элементке бирден электрон бөлүп, ар бир блок-тилке үчүн блоктун белгисинин жанына электрондордун санын жазыңыз: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. Бул мисалда, бул eribi электрондук конфигурациясы.
- Анормалдуу эмес электрондук конфигурацияларды тааныңыз. Энергиянын эң төмөнкү абалындагы атомдордун электрондук конфигурациясынын он сегиз жалпы өзгөчөлүктөрү бар, алар негизги абал деп да аталат. Жалпы эреже менен салыштырганда, алар акыркы эки-үч электрондук позициядан гана четтеп кетишет. Бул учурда, чыныгы электрондук конфигурация, электрондор атомдун стандарттык конфигурациясына караганда, төмөнкү энергетикалык абалга алып келет. Адаттан тыш атомдору:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Па (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) жана См (..., 5f7, 6d1, 7s2).
Кеңеш
- Атом ион болгондо, бул протондордун саны электрондордун санына барабар эмес экендигин билдирет. Андан кийин атомдун заряды элементтин символунун оң жагында (адатта) көрсөтүлөт. Ошондуктан +2 заряды бар сурьма атому 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p электрондук конфигурациясына ээ болот. 5p 5p болуп өзгөргөнүн эске алыңыз. Электрдик нейтралдуу атомдун конфигурациясы s жана p дан башка орбитальдарда аяктаганда этият болуңуз. Электрондорду алып салганда, валенттик орбиталдардан (s жана p орбитальдардан) гана электрондорду ала аласыз. Демек, эгер конфигурация 4s 3d менен аяктап, атом +2 зарядына ээ болсо, анда конфигурация 4s 3dге өзгөрөт. Биз 3d көрөбүзтуруктуу, бирок орбиталдагы электрондор гана алынып салынат.
- Бардык атомдор туруктуу абалга келишет, ал эми эң туруктуу электрондук конфигурацияда s жана p орбиталдары жетиштүү болот (s2 жана p6). Бул сейрек кездешүүчү газдарда мындай электрондук конфигурация бар, ошондуктан алар реакцияларга сейрек катышышат жана мезгилдик системанын оң жагында жайгашкан. Демек, эгер конфигурация 3p менен бүтсө, анда туруктуу болуш үчүн дагы эки электрон керек (алты электронду, анын ичинде орбиталдын электронун берүү көбүрөөк энергияны талап кылат, ошондуктан төрт электронду берүү оңой болмок. оңой). Эгер конфигурация 4d менен бүтсө, анда туруктуу абалга жетүү үчүн үч электронду гана берүү керек. Ошо сыяктуу эле, электрондордун жарымын (s1, p3, d5 ..) алган жаңы подкласстар туруктуу, мисалы p4 же p2, бирок s2 жана p6 дагы туруктуу болот.
- Ошондой эле, акыркы s жана p орбиталдары болгон элементтин электрондук конфигурациясын жазуу үчүн, валенттик электрон конфигурациясын колдонсоңуз болот. Демек, сурьма үчүн сурьма атомунун валенттүүлүк конфигурациясы 5s 5p.
- Иондор муну жактырбайт, анткени алар бир кыйла бышык. Ушул макаланын жогорудагы эки кадамын өткөрүп жиберип, башталган жериңизге жана сизде канча же азыраак электрон бар экендигине жараша бирдей иштеңиз.
- Электрондук конфигурациясынан атомдук номурду табуу үчүн (s, p, d, f) тамгаларынан кийинки бардык сандарды кошуңуз. Бул нейтралдуу атом болсо гана туура болот, эгер ал ион болсо, анда сиз бул ыкманы колдоно албайсыз. Анын ордуна, сиз алган же берген электрондордун санын кошуу же кемитүү керек.
- Тамгадан кийинки сан жогорку оң бурчка жазылышы керек, тест тапшырганда туура эмес жазуу керек.
- Электрондук конфигурацияларды жазуунун эки башка жолу бар. Электрондук катмардын өсүү тартибинде же электрондор орбитага жайгаштырылган тартипте, eribi атомунда көрсөтүлгөндөй жаза аласыз.
- Электронду "түртүп" көтөрүү керек болгон учурлар бар. Дал ошол учурда орбиталда бир гана электрон жетишпесе, анда жарымынын же жарымынын бардыгына ээ болсо, анда аны жакынкы s же p орбиталынан алып, ошол электронго муктаж орбиталга которуш керек.
- Кичи класстагы "энергетикалык фракциянын туруктуулугу" электрондордун жарымын алат деп айта албайбыз. Бул өтө эле жөнөкөйлөтүү. "Электрондордун жарымын" кабыл алган жаңы подкласстын энергетикалык деңгээлинин туруктуулугунун себеби, ар бир орбиталда бирден жалгыз электрон бар, ошондуктан электрон-электрон түртүшү минималдаштырылат.



